HER2 突变非小细胞肺癌现状
肺癌是全球第二大常见癌症,2020年新诊断病例超过200万[1]。转移性非小细胞肺癌(NSCLC)患者,预后特别差,只有约8%的患者在诊断后存活超过5年[2]。
HER2 是一种酪氨酸激酶受体促生长蛋白,在多种类型的肿瘤表面表达,包括肺癌、乳腺癌、胃癌和结直肠癌[3]。已在非小细胞肺癌中确定某些 HER2 基因改变(称为 HER2 突变)为不同的分子靶点,约2-4%的非鳞状非小细胞肺癌患者为HER2突变[4]。

图1 图片来源:Pexels
虽然 HER2 基因突变可发生在多种患者中,但更常见于年轻、女性和从不吸烟的非小细胞肺癌患者中。HER2 基因突变与癌细胞生长和不良预后独立相关,可导致脑转移发生率增加。目前HER2 靶向治疗在乳腺癌和胃癌中的作用已得到权威认证,但 HER2 是非小细胞肺癌 中一种新出现的生物标志物(生物标志物是指可以标记系统、器官、组织、细胞及亚细胞结构或功能的改变或可能发生的改变的生化指标,可用于疾病诊断、判断疾病分期或者用来评价新药或新疗法在目标人群中的安全性及有效性),HER2 靶向治疗尚未被批准用于非小细胞肺癌患者[5-7]。
新希望!Enhertu 在美国获得优先审评资格
2022年4月阿斯利康(AstraZeneca)和第一三共(Daiichi Sankyo)宣布Enhertu(trastuzumab deruxtecan) 在美国获得优先审评资格,用于既往接受过治疗的不可切除或转移性HER2(ERBB2) 突变非小细胞肺癌成人患者[8]。优先审评通常适用于能明显改善重大疾病的治疗、预防或诊断的在研疗法,一般来说美国食品药品监督管理局(FDA)的“优先审评”将新药上市时间大大缩短。

图2 Enhertu 英国阿斯利康 100mg
Enhertu 在美国获得优先审评资格,基于其临床疗效。阿斯利康肿瘤学研发执行副总裁 Susan Galbraith 谈到:“DESTINY-Lung01试验证实 HER2 突变是非小细胞肺癌的一个可操作的生物标志物。如果获批,Enhertu有可能成为HER2突变非小细胞肺癌的新标准治疗,为目前没有靶向治疗方案的 HER2 突变转移性非小细胞肺癌患者提供了急需的治疗方案。”
未来可期!Enhertu客观缓解率达55%
什么是enhertu?
Enhertu(又称DS8201)是针对HER2的抗体药物偶联物(ADC,通过一个化学链接将具有生物活性的小分子药物连接到单抗上,单抗作为载体将小分子药物靶向运输到目标细胞中)。Enhertu 采用第一三共专有的 DXd ADC 技术设计,是第一三共肿瘤学产品组合中的领先ADC,也是阿斯利康 ADC 科学平台中最先进的项目。
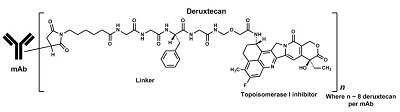
图3 Enhertu结构式
Enhertu(5.4 mg/kg) 已在40多个国家获批,用于治疗既往接受过两种或两种以上抗 HER2 方案的不可切除或转移性 HER2 阳性乳腺癌成人患者。
Enhertu(6.4 mg/kg) 已在多个国家获批,用于治疗既往接受过曲妥珠单抗治疗方案的局部晚期或转移性 HER2 阳性胃或胃食管交界处 (GEJ) 腺癌成人患者。
疗效
发表在《新英格兰医学杂志》上的DESTINY-Lung01是一项多中心、国际、II期研究,为标准治疗难治的转移性 HER2 突变非小细胞肺癌患者给药enhertu(6.4 mg/kg体重)[9]。主要结局是由独立中心审查评估的客观缓解(ORR)。次要结局包括缓解持续时间(DOR)、无进展生存期(PFS)、总生存期(OS)和安全性。共入组91例患者。中位随访时间为13.1个月 (0.7~29.1)。
客观缓解率:Enhertu治疗转移性 HER2 突变非小细胞肺癌,客观缓解率为55%(95%置信区间 [CI],44-65)。1 名患者(1%)为完全缓解,49 名患者(54%)为部分缓解。大多数患者(92%;95% CI,85 至 97)的疾病得到控制并且肿瘤大小减小。在既往接受过多种癌症治疗(包括免疫治疗)的患者和基线时有中枢神经系统 (CNS) 转移的患者中也观察到缓解。
中位缓解持续时间为9.3个月 (95%CI,5.7-14.7)。
中位无进展生存期为8.2个月 (95%CI,6.0~11.9)。
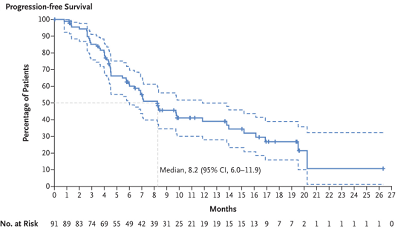
图4 无进展生存期的 Kaplan-Meier 分析
中位总生存期为17.8个月 (95%CI,13.8~22.1)。
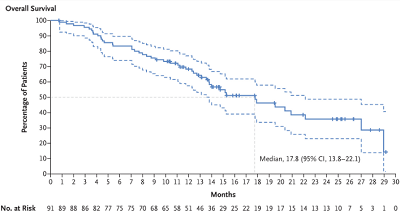
图5 总生存期的 Kaplan-Meier 分析
安全性
安全性特征与既往研究基本一致,患者发生的不良反应,大多数为 1 级或 2 级(低级),常见事件包括胃肠道和血液事件、食欲下降和脱发。46%的患者发生3级(中级)或以上药物相关不良事件,最常见的事件是中性粒细胞减少 (19%)。26%的患者发生药物相关间质性肺病。
展望
阿斯利康是一家全球的、以科学为主导的生物制药公司,专注于发现、开发肿瘤、罕见病和生物药品领域的处方药。阿斯利康总部位于英国剑桥,在100多个国家运营,其创新药物被全球数百万患者使用。阿斯利康正致力于通过对早期疾病的检测和治疗使肺癌患者更接近治愈,同时也致力于改善耐药和晚期患者的预后。通过确定新的治疗靶点和研究创新方法,公司旨在将药物与能获益最大的患者相匹配。
阿斯利康的全面产品组合包括领先的肺癌药物和下一代创新,包括奥希替尼(Tagrisso)和吉非替尼(Iressa);德瓦鲁单抗(Imfinzi,durvalumab) 和曲美木单抗(tremelimumab);与第一三共合作的Enhertu和 datopotamab deruxtecan等。希望Enhertu新适应症可以顺利通过审批,尽早惠及HER2 突变非小细胞肺癌患者。
免责声明: 以上内容整理于FDA说明书、DRUGS及网络,仅作信息交流之目的,文中观点不代表药队长立场,亦不代表药队长支持或反对文中观点。本文也不是治疗方案推荐。页面内容仅供医学药学专业人士阅读参考,具体用药请咨询主治医师,本站只做信息展示,不销售药品。如需获得治疗方案指导,请前往正规医院就诊。
参考资料: https://www.accessdata.fda.gov/scripts/cder/daf/index.cfm