重磅!胆管癌首款靶向药,佩米替尼获批上市
4月6日,国家药监局(NMPA)批准首款胆管癌靶向药物—佩米替尼(佩米替尼、pemigatinib)在国内上市[1],而早在2020年4月,佩米替尼就已获得美国药监局(FDA)加速批准,并获得“孤儿药”“突破性疗法”称号,关于中国和美国新药上市流程。相较于在国内研发上市的新药,佩米替尼又是如何在国内上市的呢?

佩米替尼 美国Incyte 4.5mg*14片
进口药在中国上市流程
佩米替尼属于进口药品,该类药品进入中国市场需要经历三个阶段[2]:
1. 办理注册证
2. 在特定口岸进口药品
3. 药品抽查检验

一、办理注册证
进口药品应当按照国务院药品监督管理部门的规定申请再注册[3]:
国外企业生产的药品取得《进口药品注册证》(所需材料如下图)
中国香港、中国澳门和中国台湾地区企业生产的药品取得《医药产品注册证》
进口国家规定范围内的精神类和麻醉类药品,须持有国务院药品监督管理部门颁发的进口准许证
取得上述证书,意味着进口药品获得了在国内销售(上市)的资格。

进口药品再注册需提交的材料
二、在特定口岸进口药品
进口药只能通过特定的口岸进口,首先企业须向口岸所在地的药品监督管理部门提前备案,获取进口药品通关单,随后海关将依据该通关单办理药品通关手续,否则将不予放行。
进口药口岸的增设
增设原则
按需设置、标准控制、严格监管、有进有出[4]。
增设流程
1.药品进口口岸必须是国家对外口岸,省级政府向国务院提交增设申请;
2.药监总局和海外总署(经药监局省局和增设口岸直属海关现场评估、研提意见后)需遵循增设原则,并参照进口药口岸标准进行评估考核,符合标准的,报国务院批准;
3.经国务院同意,对外口岸正式升级为药品进口口岸,并且药监总局和海外总署每5年评估考核一次该类口岸,不符合标准的报经国务院批准后,将取消其进口药品的资格。
三、药品抽查检验
口岸所在地药品监督管理部门通知药品检验机构,并按照国务院药品监督管理部门的规定,对进口药品进行抽查检验。
尤其是首次在国内上市的药品、国务院药品监督管理部门规定的生物制品及其他特殊类药品,甚至在销售前也会进行一次检验,以确保药品质量,但未经检验或者检验不合格的,不可销售或进口。
临床急需药品开辟快速通道
2021年,“铁马冰河”、“氯巴占”和“毒贩母亲”等字眼频频出现在热点新闻,“铁马冰河”是一位罹患罕见癫痫性脑病患儿的父亲,因代收海外购买的氯巴占包裹,被相关机构认定为“贩毒”,而氯巴占是一种能够有效控制罕见癫痫发作的药物,因具有致瘾性,被我国列为第2类严格管制的精神药品。这并不是氯巴占第一次上社会新闻,2020年家有同种罕见病患儿的母亲,也因代购该药品,被称为“毒贩母亲”[5]。
正是由于“代购氯巴占涉嫌贩毒”案的冲击,今年6月29日,国家药监局发布了《临床急需药品临时进口工作方案》和《氯巴占临时进口工作方案》的通知[6],以满足氯巴占临床用药急需,开辟临床急需药品的快速通道,这也体现了我国“以人为本”的理念,“为人民服务”的宗旨。
临床急需用药有哪些?
(1)治疗罕见病的药品
(2)防治严重危及生命疾病,且尚无有效治疗或预防手段的药品
(3)防治严重危及生命疾病,且具有明显临床优势的药品
这些药品已在国外批准上市,但尚未在国内申请再注册,无企业生产或短时期内无法恢复生产,走标准流程耗时长,但患者用药急,通过临时进口审批,能够尽快将药送到患者手中[7]。
临床急需药品申请临时进口流程
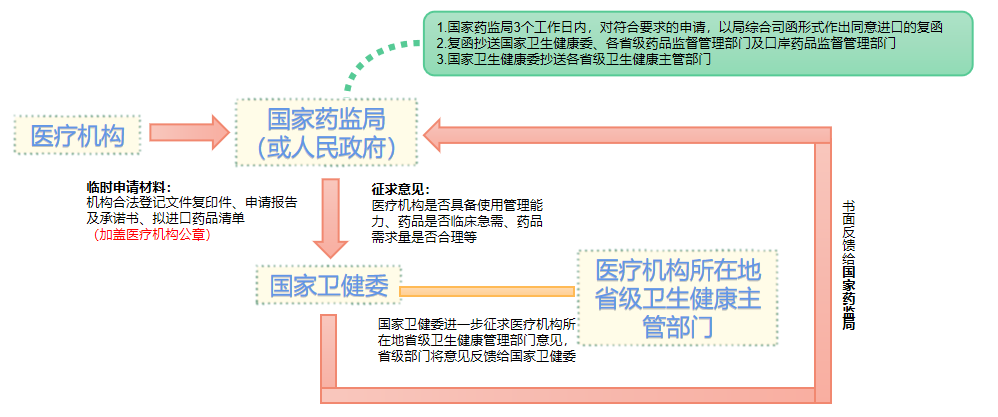
临床急需药品申请临时进口流程图
医疗机构依据药监局发布的同意出口的复函,向口岸药品监督管理部门申请办理《进口药品通关单》,通过临床急需药品审批的,无需进行口岸检验,直接送至提出申请的机构。
快速通道并不意味着逃脱检查,我国对该类药物有着严格的临床使用和上市后监督。
严格进口药品管理,加速批准境外新药上市
进口药想要在国内上市,可谓是“过五关斩六将”,我国《药品管理法》的核心是人民健康,加强进口药的管理,归根结底就是为了四个字——用药安全,尽管代购氯巴占涉嫌贩毒”案的热度已经减退,但如何让这类药物能够更快的传递到临床,仍是药品法需要完善的部分,氯巴占在美国上市后,历经两年仅在中国获得临时进口资格,如何减掉这两年的等待期,加速批准境外新药在国内上市,也是未来药品管理法制定者面临的挑战。
免责声明: 以上内容整理于FDA说明书、DRUGS及网络,仅作信息交流之目的,文中观点不代表药队长立场,亦不代表药队长支持或反对文中观点。本文也不是治疗方案推荐。页面内容仅供医学药学专业人士阅读参考,具体用药请咨询主治医师,本站只做信息展示,不销售药品。如需获得治疗方案指导,请前往正规医院就诊。
参考资料: https://www.accessdata.fda.gov/scripts/cder/daf/index.cfm







