2022年美国临床肿瘤学会(ASCO)年会已于6月4日-8日顺利召开,会议期间阿斯利康公布了DS-8201的多项研究结果,引发了大家的强烈关注,尤其是针对HER2低表达转移性乳腺癌的治疗突破。HER2一直是药物研究领域的一个热门靶点,目前已开发出多种能有效地靶向HER2癌症的新药。

图源:Cancer.Net
Trastuzumab deruxtecan(T-DXd,DS-8201)是一种抗体偶联(ADC)药物,靶向HER2,中文名为曲妥珠单抗重组冻干粉注射剂,商品名为Enhertu。

DS-8201,英国阿斯利康,100 mg
本文对2022 ASCO大会期间发布的DS-8201针对多种HER2表达肿瘤的临床研究进行介绍,期待DS-8201之后能带给我们更多惊喜。
DS-8201治疗HER2低表达转移性乳腺癌—无进展生存期翻倍
治疗困境
对于乳腺癌来说,约60%的乳腺癌患者HER2低表达,目前已有的HER2治疗药物对这些HER2低表达的癌症患者无效。
2022ASCO年会期间,阿斯利康公布了DESTINY-Breast04 III期临床试验结果,该研究纳入557例 HER2低表达转移性乳腺癌患者,其中373例患者被分配接受DS-8201治疗,184例患者接受标准化疗。所有研究受试者均患有HER2低表达转移性乳腺癌,并接受过1线或2线化疗。
疗效结果
中位随访时间为18.4个月,结果显示,与标准化疗相比,DS-8201治疗使得HER2低表达的转移性乳腺癌患者的无进展生存期延长一倍。此外,DS-8201治疗组患者的癌症生长和扩散的风险降低49%,死亡风险降低36%,且接受DS-8201治疗的受试者寿命更长。
此外,这项临床试验还确定了一个新的转移性乳腺癌亚群,称为HER2-low,可以通过DS-8201得到有效治疗。
安全性结果
在接受DS-8201治疗的患者中,严重副作用较少,但部分患者发生了严重的肺部问题。

DESTINY-Breast04 III期试验总结
总结
综上,DESTINY-Breast04的研究成果表明,DS-8201开创了HER2低表达乳腺癌患者治疗的新格局,让患者摆脱了无药可用的困境,意味着这类患者现在也可以得到有效治疗。
DS-8201治疗HER2转移性结直肠癌—活性良好,安全性和前期一致
2022ASCO会议期间,阿斯利康发布了DESTINY-CRC01(DS-8201-A-J203;NCT03384940)试验的最新数据,这是一项 II 期、开放性、多中心研究,旨在对DS-8201在表达HER2的转移性结直肠癌(mCRC)患者中的疗效和安全性进行评估。
疗效结果
截至2020年12月28日,共86例(A,53例;B,15例;C,18例)患者接受了DS-8201治疗。
在队列 A 中,客观缓解率(ORR)为45.3%(24/53例患者),疾病控制率(DCR)为83.0%(44/53例患者),中位缓解持续时间(mDOR)为7.0个月,中位无进展生存期(mPFS)为6.9个月,中位总生存期(mOS)为15.5个月。
既往抗HER2治疗患者的客观缓解率为43.8%(7/53例患者),IHC3 +状态患者为57.5%(23/53例患者),IHC2 +/ISH +状态患者为7.7%(1/53例患者)。
安全性结果
65.1%的患者(56/86)在治疗后发生≥3级的不良事件(TEAE),最常见的TEAE是血液学和胃肠道事件。
13例患者(15.1%)发生导致停药的TEAE,8例患者(9.3%)经独立委员会判定为与DS-8201 相关的间质性肺病(ILD)。
结论
在HER2表达的转移性结直肠癌患者中,DS-8201(6.4 mg/kg Q3W)显示出良好的活性和持久性,且安全性特征与既往结果一致,未来可以开展更多相关研究,探索DS-8201在该类患者中的作用。
值得注意的是,间质性肺病仍然是一种重要风险,需要仔细监测和干预。
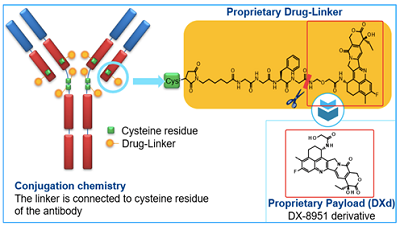
DS-8201结构图 图源:AstraZeneca
DS-8201治疗HER2表达的胆管癌—活性良好,安全性和其他研究一致
HERB试验是一项多中心II 期研究,旨在评估DS-8201治疗HER2表达的不可切除或复发性胆管癌(BTC)患者的疗效和安全性。
试验中共32例患者接受了DS-8201治疗,最终确定22例 HER2 阳性患者(不包括2例不合格患者)用于主要疗效分析。
疗效结果
HER2 阳性患者的客观缓解率(ORR)为36.4%(8/22;2例 CR 和6例PR), ORR的改善具有统计学显著性(P = 0.01)。
疾病控制率(DCR)、中位无进展生存期(mPFS)、中位总生存期(mOS)分别为81.8%、4.4个月、7.1个月。
此外,即使在HER2低表达患者中也观察到令人鼓舞的疗效:ORR、DCR、mPFS和 mOS 分别为12.5%(1/8;1 PR)、75.0%、4.2个月和8.9个月。
安全性结果
在安全性分析集(n = 32)中,81.3%(26/32)的受试者发生≥3级的TEAE;常见 TEAE 为贫血(53.1%)、中性粒细胞减少症(31.3%)和白细胞减少症(31.3%);8例患者(25.0%)发生导致停药的TEAE;8例患者(25.0%)出现间质性肺病(ILD;G1/G2/G3/G5为3/1/2/2)。
结论
DS-8201在表达HER2的胆管癌患者中显示出良好的活性,且安全性特征与其他研究基本一致,未来可以开展更多相关研究,探索DS-8201在该类患者中的作用。
DS-8201联合纳武单抗治疗HER2表达的尿路上皮癌
2022ASCO泌尿生殖系统癌症研讨会的第二天,Galsky博士在快速摘要会议上介绍了DS-8201-A-U105(NCT03523572)试验的结果,该试验旨在对DS-8201联合纳武单抗(nivolumab)治疗 HER2 表达尿路上皮癌(UC)的疗效和安全性进行评估。
早在近二十年前,就有研究在侵袭性UC 中发现 HER2过度表达,这提示了HER2在疾病进展和预后中的作用。
疗效结果
所有患者接受DS-8201的中位治疗持续时间为3.2个月,接受纳武单抗的中位治疗持续时间为4.1个月。
在队列3中,客观缓解率为36.7%,4例患者达到完全缓解(13.3%),7例患者达到部分缓解(23.3%)。中位缓解持续时间(DOR)为13.1个月,中位无进展生存期为1.9个月。
探索性生物标志物分析未显示基于 PD-L1 表达水平的客观缓解率存在任何差异。然而,在高肿瘤突变负荷的患者中,缓解者数量在数值上更高。
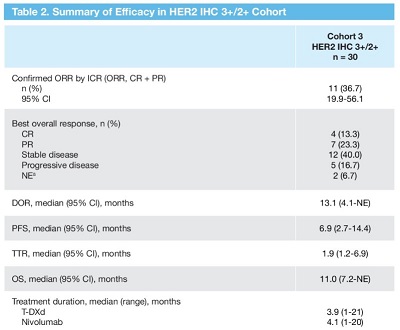
DS-8201-A-U105试验疗效总结
安全性结果
值得注意的是,在所有患者中均观察到治疗后出现的不良事件(TEAE),其中73.5%的患者发生≥3级事件(44.1%与DS-8201相关;26.5%与纳武单抗相关),所有患者中有32.4%发生导致停药的TEAE(17.6%与DS-8201相关;23.5%与纳武单抗相关)。最常见的任何级别TEAE为恶心 (73.5%)、疲乏 (52.9%) 和呕吐 (44.1%)。
所有患者中有23.5%发生药物相关性间质性肺疾病 (ILD)/非感染性肺炎(2例1级事件;4例2级事件;1例3级事件;和1例5级事件)。
结论
DS-8201联合纳武单抗在HER2高表达的尿路上皮癌患者中显示出抗肿瘤活性。
免责声明: 以上内容整理于FDA说明书、DRUGS及网络,仅作信息交流之目的,文中观点不代表药队长立场,亦不代表药队长支持或反对文中观点。本文也不是治疗方案推荐。页面内容仅供医学药学专业人士阅读参考,具体用药请咨询主治医师,本站只做信息展示,不销售药品。如需获得治疗方案指导,请前往正规医院就诊。
参考资料: https://www.accessdata.fda.gov/scripts/cder/daf/index.cfm