索托拉西布的获批认证上市情况
2021年5月,FDA加速批准索托拉西布上市,适用于KRAS G12C突变局部晚期或转移性非小细胞肺癌成人患者的治疗。2022年1月,索托拉西布在欧盟获批上市,2022年4月,索托拉西布在日本获批上市。过去四十年,针对KRAS突变基因开发的药物研究均无功而返,一度被称为“史上最棘手靶点”。索托拉西布是第一个针对KRAS基因突变而批准的靶向药,打开了历史性的缺口,给广大KRAS突变的患者带来了希望。
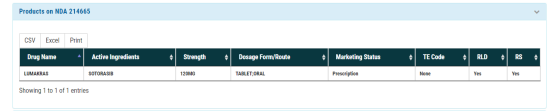
FDA批准索托拉西布上市
KRAS基因和索托拉西布
1.KRAS基因突变如何导致癌症发生
KRAS是一种GTP结合蛋白,正常情况下,它像一个体内的信号“开关”,能在“开”“关”两种状态下顺滑地切换,分别和GDP/GTP蛋白结合,进而控制下游通路的激活/关闭。一旦发生了突变,开关就会一直处在“关闭”状态,倒向GTP那端,不断地激活下游RAF、MEK及ERK等靶点,这使细胞玩命般地增殖、分化、形成肿瘤。理论上来讲,只需要设计小分子药物霸占GTP结合位点,就可以使KRAS停止激活。但是此基因表面极其光滑,只有一处能与GTP结合的点,再加上它和GTP蛋白如胶似漆地黏在一起,这使得靶向 GDP/GTP 结合位点非常具有挑战性 。
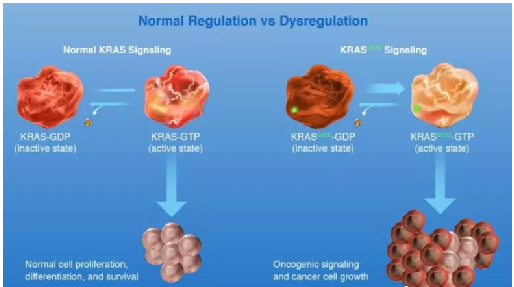
KRAS调控(图片来源Amgen官网)
2.索托拉西布如何发挥药效
KRAS基因的点突变主要有三种形式,分别是KRAS G12D突变、KRAS G12V突变和KRAS G12C突变,占比分别为41%、28%、14%。KRAS G12C是非小细胞肺癌中常见的点突变形式,而索托拉西布正是针对这一突变的靶向药物。索托拉西布通过取代甘氨酸与kRAS G12C独特的半胱氨酸形成不可逆共价键,将蛋白质锁定在非活性GDP结合状态,阻断下游信号激活。
索托拉西布的优势
1.索托拉西布口服给药,方便快捷
索托拉西布也是全球首款针对该突变的口服靶向药,口服药方便快捷,还能避免患者长期注射的不适感。推荐剂量为960mg(8片),每天一次,直至疾病进展或出现不可接受的毒性。如果漏服超过当日服药时间6小时以上,请跳过该剂量。第二天服药仍按照原剂量服用,不要同时服用2剂来弥补错过的剂量。吞服整粒药片,不要咀嚼或压碎药片。
2.索托拉西布具有临床意义的抗癌活性
索托拉西布在FDA的加速获批基于CodeBreaK 100的I/II期的研究结果,研究者对124名局部晚期或转移性KRAS G12C突变非小细胞肺癌患者使用索托拉西布治疗,结果显示客观缓解率为36%,其中58%的患者缓解持续时间为6个月或更长。
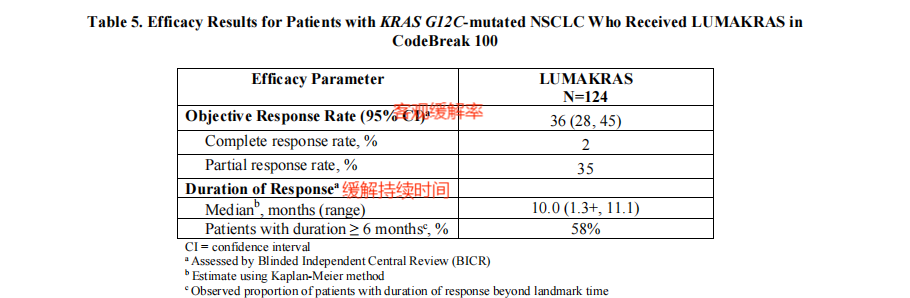
CodeBreaK 100的I/II期临床研究
索托拉西布在欧盟的获批是基于CodeBreaK 100的II期临床试验。在124例接受过化疗和/或免疫疗法、出现疾病进展的KRAS G12C突变的非小细胞肺癌患者,疗效显著。
结果如下:
客观缓解率为37.1%,这意味着近4成患者的肿瘤缩小了30%以上;
疾病控制率为80.6%,80%受试患者均达到了临床疾病稳定(肿瘤缩小没有达到30%,但也没有达到进展的程度)
中位持续缓解时间为11.1个月,非小细胞肺癌患者处于稳定或持续缓解的状态达到接近一年(缓解持续时间越长,患者最终的生存期越长);
中位总生存期12.5个月,代表着半数患者活过了1年。

CodeBreaK 100的II期临床试验
3.安全可耐受
患者都很关心药物副作用,毕竟副作用过大会严重影响生活质量。值得一提的是,索托拉西布的耐受性较好,主要的不良反应是腹泻、肌肉骨骼痛、恶心、疲劳感、肝毒性和咳嗽。暂未发现4级以上的不良反应,因此患者和家属大可以放心。
索托拉西布的其他试验
在一项 1 期、多中心、开放标签试验中(编号:NIHMS1632163),索托拉西布在经过大量预处理的KRAS p.G12C 突变实体瘤患者中显示出有前途的抗癌活性。该研究的主要负责人员David S Hong博士还表示,他认为未来还可以研究索托拉西布与其他药物(例如化疗或靶向药)的联合方案,以提高疗效,造福更多患者。

此试验的主要研究人员:David S Hong 医学博士 德克萨斯大学 安德森癌症中心癌症治疗学系副主席
一项扩大索托拉西布癌种应用范围的试验(编号:NCT04667234)11月15日刚刚在试验平台注册。
一项索托拉西布联合化疗二线治疗胰腺癌的试验(编号:NCT05251038)尚在进行中,预计2025年完成。
一项VIC-1911(新一代高选择性口服Aurora A激酶小分子抑制剂) 单药联合索托拉西布治疗 KRAS G12C 突变型非小细胞肺癌的研究(编号:NCT05374538)正准备招募患者,预计2025年11月完成。
索托拉西布的注意事项
1.肝毒性:开始用药后的前三个月,每3周监测一次肝功能,然后每月监测一次,对出现转氨酶或胆红素升高的患者要更频繁地进行监测。根据不良反应的严重程度,暂停、减少剂量或永久停用此药。
2.间质性肺病(ILD)/肺炎:监测新的或恶化的肺部症状。对于疑似ILD/肺炎,既可停用此药,如果未发现ILD/肺炎的其他潜在原因,则永久停用。
3.患者使用索托拉西布治疗时,需要注意以上注意事项,避免发生危害。
关于索托拉西布悬而未决的问题仍然存在,例如什么时候是使用索托拉西布治疗的最佳时机,例如索托拉西布是哪个KRAS突变癌种的最佳治疗选择。未来的试验仍需进一步阐明索托拉西布在新辅助、局部晚期和一线治疗中的有效性。总而言之,索托拉西布的上市对KRAS G12C突变的局部晚期或转移性非小细胞肺癌患者来说是一个好消息。我们也希望未来能有越来越多针对KRAS突变的靶向药物上市,让更多KRAS突变的患者获益。
免责声明: 以上内容整理于FDA说明书、DRUGS及网络,仅作信息交流之目的,文中观点不代表药队长立场,亦不代表药队长支持或反对文中观点。本文也不是治疗方案推荐。页面内容仅供医学药学专业人士阅读参考,具体用药请咨询主治医师,本站只做信息展示,不销售药品。如需获得治疗方案指导,请前往正规医院就诊。
参考资料: FDA说明书,FDA更新于2025年1月的说明书https://www.accessdata.fda.gov/scripts/cder/daf/index.cfm?event=overview.process&ApplNo=214665