概述
阿替利珠单抗(TECENTRIQ、Atezolizumab,T药)是一种程序性死亡配体(PD-L1)阻断人源化单克隆抗体。用于治疗局部晚期或转移性尿路上皮癌。随后,其适应症不断扩大,涉及非鳞非小细胞肺癌、小细胞肺癌、三阴性乳腺癌和肝细胞癌等多个癌种,为临床提供了更多的治疗选择。
2018年12月6日,美国食品药品监督管理局批准阿替利珠单抗(TECENTRIQ, Genentech, Inc.)联合贝伐单抗、紫杉醇和卡铂用于转移性非鳞状非小细胞肺患者的一线治疗无EGFR或ALK基因组肿瘤畸变的癌症(NSq NSCLC)。
临床试验
批准基于IMpower150试验(NCT02366143),这是一项开放标签、随机(1:1:1)、三组试验,招募了1202名接受转移性NSq NSCLC一线治疗的患者。87%(1045名患者)被确定为没有 EGFR或ALK肿瘤突变。该试验旨在对每个含阿特珠单抗的臂与对照组进行比较。患者被随机分配接受以下治疗:
阿特珠单抗、卡铂(Carboplatin)、紫杉醇(Abraxane、Paclitaxel)和贝伐单抗(Bevacizumab、Avastin)(四药方案);
阿替利珠单抗、卡铂和紫杉醇(三药方案);或者
卡铂、紫杉醇和贝伐单抗(对照组)。
试验终点
在完成4或6个周期的卡铂和紫杉醇治疗后,患者在四药组和对照组继续接受贝伐单抗治疗,并在两个实验组继续接受阿特珠单抗治疗,直至疾病进展或出现不可接受的毒性。主要疗效指标是总生存期(OS)和无进展生存期(PFS)。
试验结果
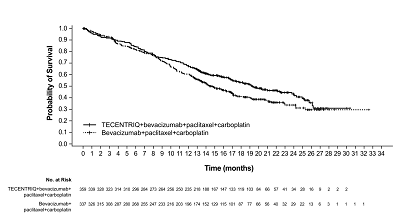
在没有EGFR或ALK突变的NSq NSCLC患者中,接受4种药物方案的患者的估计中位OS为19.2个月,接受卡铂、紫杉醇和贝伐单抗的患者的估计中位OS为14.7个月(风险比[HR]0.78;95% CI:0.64,0.96;p=0.016)。接受四种药物方案的患者估计中位PFS为8.5个月,而对照组为7.0个月(HR 0.71;95% CI 0.59,0.85;p=0.0002)。4种药物组的总体反应率为55%,对照组为 42%。在三种药物组和对照组之间未观察到中期OS或最终PFS的显着差异。
图1:IMpower150试验中人群总生存率的Kaplan-Meier分析曲线
不良反应分析
阿替利珠单抗与卡铂、紫杉醇和贝伐单抗联合用药最常见的不良反应(报告在≥20%的患者中)是疲劳/虚弱、脱发、恶心、腹泻、便秘、食欲下降、关节痛、高血压和神经病变。15%的患者因不良反应停用阿替利珠单抗;导致阿特珠单抗停药的最常见不良反应是肺炎(1.8%)。
在支持已批准适应症的临床研究中,针对阿替利珠单抗(抗药物抗体,ADA)的开发抗体的发生率从30%到42%不等。在IMpower150研究中接受四种药物方案的364名NSCLC患者中,36%(n=132)有针对阿替利珠单抗的治疗出现抗体,其中大多数(这132名患者中的83%)在接受第二次阿替利珠单抗之前患有ADA剂量。与ADA阴性的患者相比,治疗出现的ADA检测呈阳性的患者全身阿特珠单抗暴露量较低。
在探索性分析中,ADA阳性(0.69;95% CI:0.44,1.07)和ADA阴性亚组(0.64;95% CI:0.46,0.90)中OS的HR相似。ADA的存在既没有增加不良反应的发生率,也没有增加不良反应的严重程度。




 阿替利珠单抗
阿替利珠单抗  瑞士罗氏
瑞士罗氏 
 英国阿斯利康
英国阿斯利康 
 美国G1 Therapeutics
美国G1 Therapeutics 
 德国默克
德国默克 

 印度natco
印度natco 
 中国百济神州
中国百济神州 









评论