恩曲他滨替诺福韦片(Truvada)的说明书
恩曲他滨替诺福韦片(Truvada)主要具有抗病毒的功效,适用于与其他抗逆转录病毒药物联用,作为一种核苷酸类反转录酶抑制剂,它能够阻止艾滋病病毒(HIV)反转录酶,减少病毒复制。目前恩曲他滨替诺福韦片已经在国内上市,本文就恩曲他滨替诺福韦片的适应症、用法用量、副作用、禁忌、临床疗效等进行了详细说明。
(一)适应症
1.HIV-1感染的治疗
恩曲他滨替诺福韦片适用于与其他抗逆转录病毒药物联合治疗成人和体重至少17公斤的儿童患者的HIV-1感染。
2.HIV-1暴露前预防(PrEP)
恩曲他滨替诺福韦片适用于体重至少35公斤的高危成人和青少年进行暴露前预防(PrEP),以降低性获得性HIV-1感染的风险。在开始使用恩曲他滨替诺福韦片治疗HIV-1PrEP之前,个人必须立即进行HIV-1阴性检测。

恩曲他滨替诺福韦片
(二)用法用量
1.开始使用恩曲他滨替诺福韦片治疗HIV-1感染或HIV-1PrEP准备之前的检测
在开始使用恩曲他滨替诺福韦片之前或开始使用恩曲他滨替诺福韦片时,对患者进行乙型肝炎病毒感染检测。
在开始使用恩曲他滨替诺福韦片之前和使用期间,按照临床适当的时间表,评估所有个体的血清肌酐、估计肌酐清除率、尿糖和尿蛋白。慢性肾病患者还需要评估血清磷。
2.接受恩曲他滨替诺福韦片的HIV-1PrEP筛查
在开始使用恩曲他滨替诺福韦片进行HIV-1PrEP之前,立即对所有个体进行HIV-1感染筛查,并且在服用恩曲他滨替诺福韦片期间至少每3个月进行一次筛查,并在诊断出任何其他性传播感染(STIs)时,对所有人进行HIV-1感染筛查。
3.治疗成人和体重至少35公斤的儿童HIV-1感染的推荐剂量
恩曲他滨替诺福韦片是一种含有恩曲他滨(FTC)和富马酸替诺福韦二吡酯(TDF)的双药固定剂量组合产品。对于成人和体重至少35公斤的儿童患者,恩曲他滨替诺福韦片的推荐剂量为每日一次,一片(含200mgFTC和300mgTDF),随餐或不随餐口服。
4.治疗体重至少17公斤且能够吞咽片剂的儿童HIV-1感染的推荐剂量
对于体重至少17公斤且可以吞咽片剂的儿科患者,恩曲他滨替诺福韦片的推荐口服剂量见表1。药片应每天服用一次,可随餐或不随餐服用。患者还应定期监测体重,并相应调整恩曲他滨替诺福韦片剂量。
表1:体重17公斤至35公斤以下儿科患者HIV-1感染的治疗剂量

5.体重至少35公斤的成人和青少年HIV-1PrEP的推荐剂量
对于体重至少35公斤的HIV-1未感染的成人和青少年,恩曲他滨替诺福韦片用于HIV-1PrEP的剂量为每日一次,一片(含200mgFTC和300mgTDF),可随餐或不随餐服用。
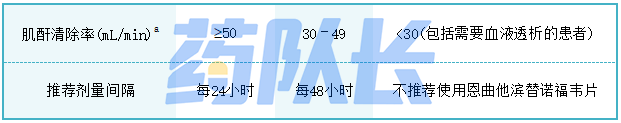
6.肾损害患者的剂量调整
HIV-1感染的治疗
表2提供了肾损害患者的剂量间隔调整。轻度肾功能损害的HIV-1感染患者(肌酐清除率50-80mL/min)无需调整剂量。中度肾功能损害患者(肌酐清除率30-49mL/min)的给药间隔调整建议的安全性和有效性尚未得到临床评价。因此,应密切监测这些患者对治疗的临床反应和肾功能。
没有数据可用于儿科肾损害患者的剂量推荐。
表2:肌酐清除率改变的HIV-1感染成人患者的剂量间隔调整
对于估计肌酐清除率低于60mL/min的HIV-1未感染个体,不推荐恩曲他滨替诺福韦片用于HIV-1PrEP。
如果在使用恩曲他滨替诺福韦片进行HIV-1PrEP时观察到未感染个体估计肌酐清除率下降,评估潜在原因并重新评估继续使用的潜在风险和益处。
(三)适用人群
成人。妊娠期、哺乳期女性,儿童以及老年患者在医生指导下用药。
(四)禁忌症
HIV-1PrEP的恩曲他滨替诺福韦片禁用于未知或阳性HIV-1状态的个体。
(五)副作用
在HIV-1感染患者中,最常见的不良反应(发生率大于或等于10%)是腹泻、恶心、疲劳、头痛、头晕、抑郁、失眠、异梦和皮疹。
在PrEP试验中未感染HIV-1的成年人中,超过2%的恩曲他滨替诺福韦片参与者报告的不良反应是头痛、腹痛和体重下降,比安慰剂参与者报告的不良反应更频繁。
(六)注意事项
1.乙肝病毒感染者乙型肝炎严重急性加重
在开始使用恩曲他滨替诺福韦片之前或之后,所有个体都应进行慢性乙型肝炎病毒(HBV)检测。
停止恩曲他滨替诺福韦片治疗的HBV感染者应在停止治疗后至少几个月通过临床和实验室随访密切监测。在适当的情况下,抗乙型肝炎治疗是必要的,特别是在治疗后患有晚期肝病或肝硬化的个体肝炎加重可导致肝功能失代偿和肝功能衰竭。应向未感染乙肝病毒的个体提供疫苗接种。
2.新发或恶化的肾脏损害
恩曲他滨和替诺福韦主要由肾脏排出。使用恩曲他滨替诺福韦片的一种成分TDF,有肾损害的报道,包括急性肾功能衰竭和Fanconi综合征(肾小管损伤伴严重低磷血症)。恩曲他滨替诺福韦片应避免同时或近期使用肾毒性药物(如大剂量或多种非甾体抗炎药)。
3.免疫重建综合征
在接受包括恩曲他滨替诺福韦片在内的抗逆转录病毒联合治疗的HIV-1感染患者中出现免疫重建综合征。这可能需要进一步评估和治疗。
4.骨质流失和矿化缺陷
在HIV-1感染成人的临床试验和HIV-1未感染个体的临床试验中,TDF(恩曲他滨替诺福韦片的一种成分)与骨矿物质密度(BMD)的略微较大下降和骨代谢生化标志物的增加相关,接受TDF的受试者血清甲状旁腺激素水平和1,25维生素D水平也较高。
5.乳酸酸中毒/严重肝肿大伴脂肪变性
乳酸性酸中毒和严重肝肿大合并脂肪变性,包括死亡病例,已报道使用核苷类似物,包括FTC和TDF,恩曲他滨替诺福韦片的组成部分,单独或与其他抗逆转录病毒药物联合使用。如果出现临床或实验室结果提示乳酸性酸中毒或明显的肝毒性(即使没有明显的转氨酶升高,也可能包括肝肿大和脂肪变性),则应暂停恩曲他滨替诺福韦片治疗。
6.药物相互作用引起的不良反应风险
同时使用恩曲他滨替诺福韦片和其他药物可能会导致已知的或潜在的重大药物相互作用,其中一些可能会导致可能的临床重大不良反应,在恩曲他滨替诺福韦片治疗期间复查伴随用药。并监测伴随用药的不良反应。
(七)治疗效果
1.试验设计
在GEMINI试验的48周主要分析中,2种药物方案多替拉韦+拉米夫定在未接受治疗的成人中实现HIV-1RNA<50拷贝/毫升方面不劣于多替拉韦+富马酸替诺福韦二吡呋酯/恩曲他滨。我们展示了预先设定的96周二次分析的结果。
2.试验结果的设定
GEMINI-1和GEMINI-2是相同的双盲III期研究。筛选HIV-1RNA≤500,000拷贝/毫升的参与者按1:1随机分配接受每日一次多替拉韦+拉米夫定或多替拉韦+富马酸替诺福韦酯/恩曲他滨治疗。
3.试验结果
与48周数据一致,多替拉韦+拉米夫定表现出与多替拉韦+富马酸替诺福韦二吡呋酯/恩曲他滨相比不劣于多替拉韦+富马酸替诺福韦二吡呋酯/恩曲他滨的长期疗效,且不会增加治疗中出现耐药性的风险,支持其用于未接受治疗的HIV-1感染者。
(八)药物相互作用
1.影响肾功能的药物
FTC和替诺福韦主要由肾脏通过肾小球滤过和活跃的小管分泌排出。没有观察到由于肾脏排泄竞争引起的药物相互作用。然而,恩曲他滨替诺福韦片与被活跃的小管分泌消除的药物合用可能会增加FTC、替诺福韦和/或合用药物的浓度。
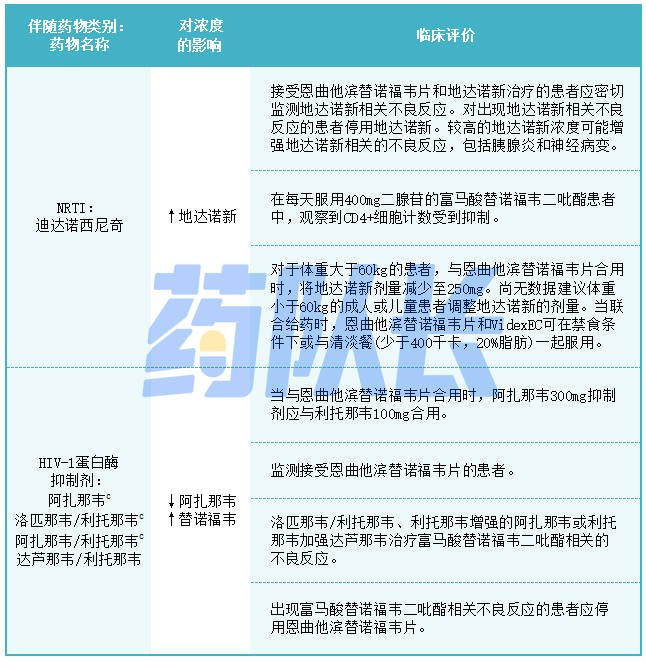
2.既定和重要的互动
表7列出了已确定的或具有临床意义的药物相互作用。所描述的药物相互作用是基于使用恩曲他滨替诺福韦片、恩曲他滨替诺福韦片成分(FTC和TDF)作为单独药物和/或联合药物进行的研究,或者是预测与恩曲他滨替诺福韦片可能发生的药物相互作用。
表7:已确定的和显著的药物相互作用:根据药物相互作用试验,可以推荐改变剂量或方案

(九)储存条件
储存在25°C(77°F),允许在15°C-30°C(59°F-86°F)之间浮动。
【温馨提示】:部分商品说明书更换频繁,请以商品实物为准。

1. HIV-1感染的治疗
恩曲他滨替诺福韦片适用于与其他抗逆转录病毒药物联合治疗成人和体重至少17公斤的儿童患者的HIV-1感染。
2. HIV-1暴露前预防(PrEP)
恩曲他滨替诺福韦片适用于体重至少35公斤的高危成人和青少年进行暴露前预防(PrEP),以降低性获得性HIV-1感染的风险。在开始使用恩曲他滨替诺福韦片治疗HIV-1PrEP之前,个人必须立即进行HIV-1阴性检测。