温馨提示: 药品图片来自网络,仅供参考;如遇新包装上市可能存在上新滞后,请以实物为准,如有侵权,请联系删除
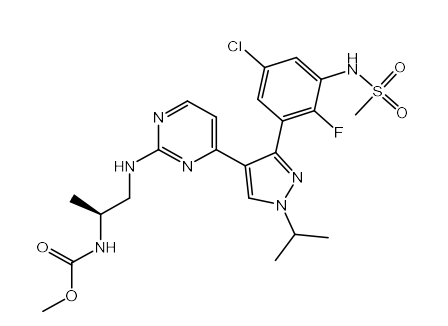
本品的主要活性成分为encorafenib
其化学结构如下:
1.患者选择
(1)BRAF V600E或V600K突变阳性不可切除或转移性黑色素瘤
在开始用药前,确认肿瘤标本中存在BRAF V600E或V600K突变。
(2)BRAF V600E突变阳性转移性结直肠癌
在开始用药前,确认肿瘤标本中存在BRAF V600E突变。
2.推荐剂量
(1)BRAF V600E或V600K突变阳性不可切除或转移性黑色素瘤
本品的推荐剂量为450mg(6粒75mg胶囊),每日一次口服,与比美替尼联合使用,直至疾病进展或不可接受的毒性,请参考比美替尼处方信息获取比美替尼的推荐剂量。
(2)BRAF V600E突变阳性转移性结直肠癌
本品的推荐剂量为300mg(4粒75mg胶囊),每日一次口服,与西妥昔单抗联合使用,直至疾病进展或不可接受的毒性,请参考西妥昔单抗处方信息获取西妥昔单抗的推荐剂量。
3.管理
(1)本品可随饮食或不随饮食服用,在下一剂用药的12小时内,不要补服漏服的剂量。
(2)如果服用本品后出现呕吐,则不要再服用额外剂量,而是按照用药计划继续服用下一剂。
4.不良反应的剂量调整
(1)BRAF V600E或V600K突变阳性不可切除或转移性黑色素瘤
如果停用比美替尼,将本品用量减少至最大剂量为300mg(4粒75mg胶囊)每日一次,直到比美替尼恢复用药,本品治疗相关不良反应的剂量减少见表1。
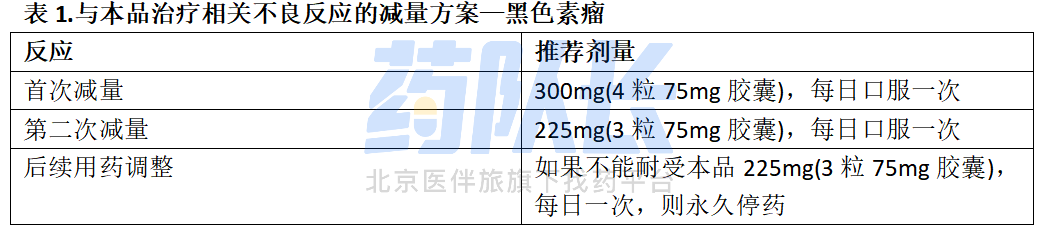
(2)BRAF V600E突变阳性转移性结直肠癌
如果停用西妥昔单抗,则停用本品,本品治疗相关不良反应的剂量减少见表2。
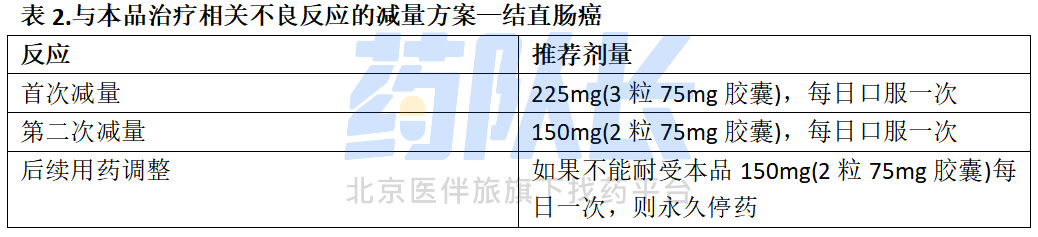
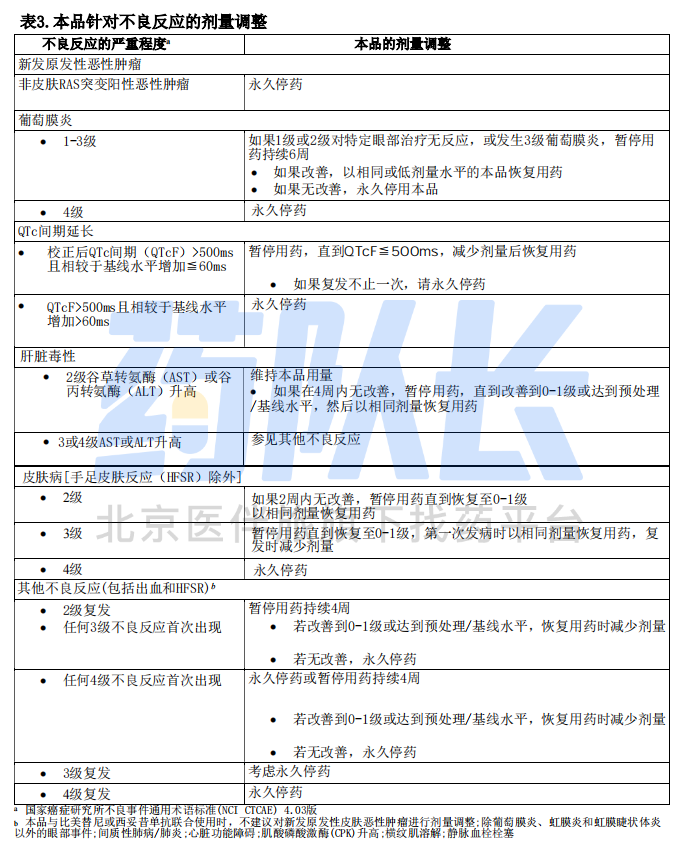
(3)BRAF V600E或V600K突变阳性的不可切除或转移性黑色素瘤和BRAF V600E突变阳性的转移性结直肠癌
本品治疗相关不良反应的剂量调整方案见表3,请参考比美替尼或西妥昔单抗处方信息,适当调整与每种药物相关不良反应的剂量。
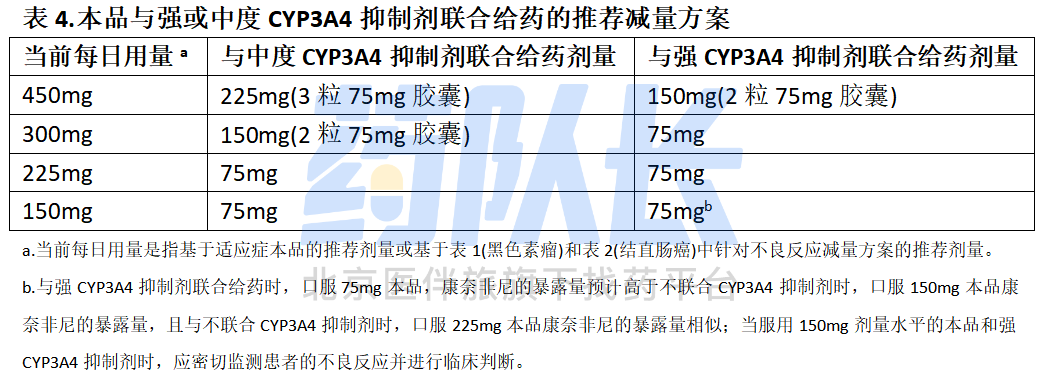
5.与强或中度CYP3A4抑制剂联合给药的剂量调整
应避免本品与强或中度CYP3A4抑制剂联合给药,否则请根据表4中的建议减少本品剂量,并且在抑制剂停药3-5个消除半衰期后,重新恢复CYP3A4抑制剂用药前本品的用量。
1.本品联合比美替尼治疗黑色素瘤最常见的不良反应(>25%)是疲劳、恶心、呕吐、腹痛和关节痛。
2.本品联合西妥昔单抗治疗结直肠癌最常见的不良反应(>25%)是疲劳、恶心、腹泻、痤疮样皮炎、腹痛、食欲下降、关节痛和皮疹。
1.新发原发性恶性肿瘤
在接受BRAF抑制剂治疗的患者中观察到新发原发性皮肤和非皮肤恶性肿瘤,并且可能与本品治疗同时发生。
(1)皮肤恶性肿瘤
在开始治疗前、治疗期间每2个月以及治疗后的6个月内进行皮肤病学评估,可通过皮肤病理学评估,切除和处理可疑的皮肤损伤,不建议对新发原发性皮肤恶性肿瘤进行剂量调整。
(2)非皮肤恶性肿瘤
根据其作用机制,本品可通过突变或其他机制引发与RAS激活相关的恶性肿瘤,应监测接受本品治疗的患者是否出现非皮肤恶性肿瘤的体征和症状,对于RAS突变阳性的非皮肤恶性肿瘤,停用本品。
2.促进BRAF野生型肿瘤生长
体外实验已证明了在暴露于BRAF抑制剂的BRAF野生型细胞中,可导致MAP-激酶信号传导的反常激活和细胞增殖的加快,因此在开始用药前,请确认存在BRAF V600E或V600K突变。
3.出血
应根据不良反应的严重程度,暂停用药、减少剂量或永久停药。
4.葡萄膜炎
每次就诊时应评估患者的视力情况,定期对新发或恶化的视力障碍进行眼科评估,并持续性跟踪最新的眼科检查结果,可根据不良反应的严重程度,暂停用药、减少剂量或永久停药。
5.QTc间期延长
(1)监测已经患有QTc间期延长或极有可能发展为QT间期延长的患者,包括已知患有长QT综合征、具有临床意义的缓慢性心律失常、严重或未控制的心力衰竭患者,以及正在服用与QT间期延长相关的其他药物的患者。
(2)在服用本品前和用药期间纠正低钾血症和低镁血症。
(3)对于QTc间期>500ms的患者,暂停用药、减少剂量或永久停药。
6.胚胎-胎儿毒性
在本品治疗期间和治疗后2周内会使激素避孕药无效,因此应告知女性本品对胎儿的潜在风险,建议有生殖能力的女性采取有效的非激素避孕方法。
(以上参考自美国药监局FDA药品说明书2022.02版)
免责声明: 以上内容整理于FDA、DRUGS、网络,仅作信息交流之目的,文中观点不代表药队长立场,亦不代表药队长支持或反对文中观点。本文也不是治疗方案推荐。页面内容仅供医学药学专业人士阅读参考,具体用药请咨询主治医师,本站只做信息展示,不销售药品。如需获得治疗方案指导,请前往正规医院就诊。
参考资料: FDA说明书,FDA更新于2024年12月的说明书https://www.accessdata.fda.gov/scripts/cder/daf/index.cfm?event=overview.process&ApplNo=210496
- 药品知识
- 药品信息
- 康奈非尼的适应症是什么? 康奈非尼是一种用于治疗黑色素瘤和结直肠癌的药物,其适应症主要包括以下情...[ 详情 ]推荐指数:276 2023-09-19
- 康奈非尼的注意事项是什么? 康奈非尼是一种常用于治疗黑色素瘤和结直肠癌的靶向治疗药物。在使用康奈非...[ 详情 ]推荐指数:263 2023-09-19
- 治疗黑色素瘤和结直肠癌的有效药物-康奈非尼的副作用大吗? 最近很多病友咨询这个康奈非尼,很多病友很关心这个副作用方面的问题,俗话...[ 详情 ]推荐指数:293 2023-08-02
- 康奈非尼治疗黑色素瘤可延长患者生命近10个月!价格如何? 最近很多患者看到了康奈非尼在治疗黑色素瘤上的效果,想知道这个药物202...[ 详情 ]推荐指数:691 2023-08-03
-
【青光眼或高眼压症】DE-117B滴眼液
[适应症]原发性开角型青光眼或高眼压症[试验分期]Ⅲ期
-
【肝功能不全】LH-1801片
[适应症]肝功能不全[试验分期]Ⅰ期
-
【系统性红斑狼疮】C-CAR168细胞回输注射液
[适应症]系统性红斑狼疮[试验分期]Ⅱ期
-
【复发脑胶质瘤】GNC-039四特异性抗体注射液
[适应症]复发脑胶质瘤(病理确诊为四级星型细胞瘤和四级胶质母细胞瘤)[试验分期]Ⅰ期