温馨提示: 药品图片来自网络,仅供参考;如遇新包装上市可能存在上新滞后,请以实物为准,如有侵权,请联系删除
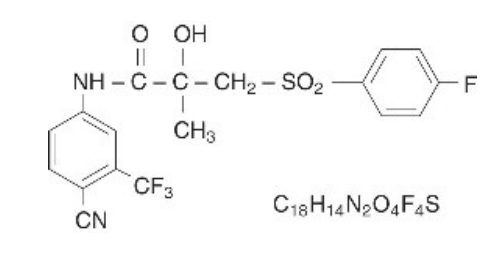
本品是一种非甾体雄激素受体抑制剂,其化学结构式为:
1.推荐剂量和时间表
本品联合促黄体激素释放激素类似物治疗的推荐剂量为50mg,每日1次(早晨或晚上),伴或不伴进食,建议每天同一时间服用,治疗应与促黄体激素释放激素类似物治疗同时开始,如果错过了一剂本品,在预定的时间服用下一剂,请勿服用错过的剂量或在下一剂量加倍。
2.肾功能损害的剂量调整
肾损害患者无需调整剂量。
3.肝损害的剂量调整
轻中度肝功能损害患者无需调整剂量,在严重肝损害患者(n=4)中,虽然本品活性对映体的半衰期增加了76%(正常患者为5.9天,受损患者为10.4天),但不需要调整剂量。
在接受本品联合促黄体激素释放激素(LHRH)类似物治疗的患者中,超过10%的不良反应包括:潮热、疼痛(包括全身、背部、骨盆和腹部)、虚弱、便秘、感染、恶心、周围水肿、呼吸困难、腹泻、血尿、夜尿和贫血。
1.肝炎
(1)由于严重肝损伤(肝功能衰竭)导致的死亡或住院病例在上市后与本品的使用有关,这些报告中的肝毒性通常发生在治疗的前三到四个月,在对照临床试验中,约1%的使用本品的患者出现肝炎或肝酶显著升高导致停药。
(2)在开始使用本品治疗前,应定期测定血清转氨酶水平,治疗的前四个月应定期测定,治疗后应定期测定,如果出现提示肝功能障碍的临床症状或体征(如恶心、呕吐、腹痛、疲劳、厌食、“流感样”症状、尿色变深、黄疸或右上象限压痛),应立即测定血清转氨酶,特别是血清ALT,如果患者在任何时候出现黄疸,或ALT高于正常上限2倍以上,应立即停药并密切随访肝功能。
2.合并使用香豆素抗凝剂的出血
上市后有报道称,在先前使用香豆素抗凝剂稳定的患者使用本品后,凝血酶原时间(PT)和国际标准化比率(INR)在数天至数周内过度延长,部分患者出现颅内、腹膜后和胃肠道严重出血,需要输血和/或给予维生素k治疗,密切监测凝血酶原时间/国际标准化比率,根据需要调整抗凝剂量。
3.男性乳房发育和乳房疼痛
在将本品 150mg作为前列腺癌单药的临床试验中,分别有38%和39%的患者出现了男性乳房发育症和乳房疼痛。
4.葡萄糖耐量
在接受促黄体激素释放激素激动剂的男性中观察到葡萄糖耐量的降低,这可能表现为糖尿病或糖尿病患者失去血糖控制,因此,应考虑在接受本品联合促黄体激素释放激素激动剂治疗的患者中监测血糖。
5.实验室检查
定期评估血清前列腺特异性抗原(PSA)可能有助于监测患者的反应,如果在使用本品治疗期间血清前列腺特异性抗原水平升高,应评估患者的临床进展,对于客观疾病进展并血清前列腺特异性抗原升高的患者,可以考虑在继续使用促黄体激素释放激素类似物的同时,停用抗雄激素治疗一段时间。
(以上内容参考自美国FDABicalutamide说明书2017.10版)
免责声明: 以上内容整理于FDA、DRUGS、网络,仅作信息交流之目的,文中观点不代表药队长立场,亦不代表药队长支持或反对文中观点。本文也不是治疗方案推荐。页面内容仅供医学药学专业人士阅读参考,具体用药请咨询主治医师,本站只做信息显示,不销售药品。如需获得治疗方案指导,请前往正规医院就诊。
参考资料: FDA说明书,FDA更新于2008年12月的说明书,https://www.accessdata.fda.gov/scripts/cder/daf/index.cfm?event=overview.process&ApplNo=022310
- 药品知识
- 药品信息
- 比卡鲁胺是化疗药还是靶向药? 比卡鲁胺片,适用于局部晚期、无远处转移的前列腺癌患者,或与促黄体生成素...[ 详情 ]推荐指数:362 2024-01-12
- 比卡鲁胺治疗前列腺癌的临床疗效 比卡鲁胺联合治疗前列腺癌的临床疗效与氟他胺联合治疗的临床疗效相当,两者...[ 详情 ]推荐指数:701 2022-07-06
- 比卡鲁胺有副作用吗? 比卡鲁胺是一种常用于治疗前列腺癌的药物,但它也可能引起一些副作用。本文...[ 详情 ]推荐指数:405 2023-08-22
- 比卡鲁胺的疗效怎么样? 推荐指数:363 2023-08-22
-
【青光眼或高眼压症】DE-117B滴眼液
[适应症]原发性开角型青光眼或高眼压症[试验分期]Ⅲ期
-
【肝功能不全】LH-1801片
[适应症]肝功能不全[试验分期]Ⅰ期
-
【系统性红斑狼疮】C-CAR168细胞回输注射液
[适应症]系统性红斑狼疮[试验分期]Ⅱ期
-
【复发脑胶质瘤】GNC-039四特异性抗体注射液
[适应症]复发脑胶质瘤(病理确诊为四级星型细胞瘤和四级胶质母细胞瘤)[试验分期]Ⅰ期