司美替尼(Koselugo)的说明书
司美替尼(Koselugo)是一种可口服的、选择性的、非竞争性的ATP活性的MEK1/2抑制剂。它在BRAF或RAS突变细胞系和各种异种移植活体模型中均表现出抗肿瘤活性。司美替尼用于治疗2岁及2岁以上的1型神经纤维瘤病(NF1)儿童患者,这些患者携带有表现出症状或进行性、不能通过手术治疗的丛状神经纤维瘤。目前司美替尼已经在国内上市,本文就司美替尼的适应症、用法用量、副作用、禁忌、临床疗效等进行了详细说明。
(一)适应症
司美替尼适用于治疗2岁及以上有1型神经纤维瘤病(NF1)症状、不能手术的丛状神经纤维瘤(PN)患者。
司美替尼
(二)用法用量
1.建议用量
司美替尼的推荐剂量为25mg/m²,每日口服两次(约每12小时一次),直至疾病进展或出现不可接受的毒性。
空腹服用司美替尼。每次给药前2小时或每次给药后1小时不要进食,基于体表面积(BSA)的司美替尼推荐剂量见表1。
表1基于体表面积(BSA)的司美替尼推荐剂量

BSA小于0.55m²患者的推荐剂量尚未确定。
司美替尼胶囊整粒用水吞下。请勿咀嚼、溶解或打开胶囊。
不要给不能吞下整粒胶囊的患者服用。
除非距离下一次预定剂量超过了6小时,否则不要漏服司美替尼。
如果在服用司美替尼后出现呕吐,请不要再服用额外剂量,而是继续服用下一个计划剂量。
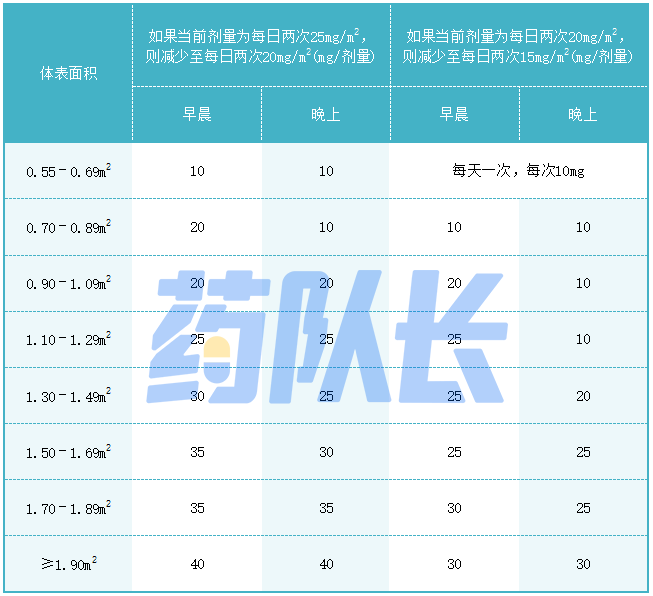
2.不良反应的剂量调整
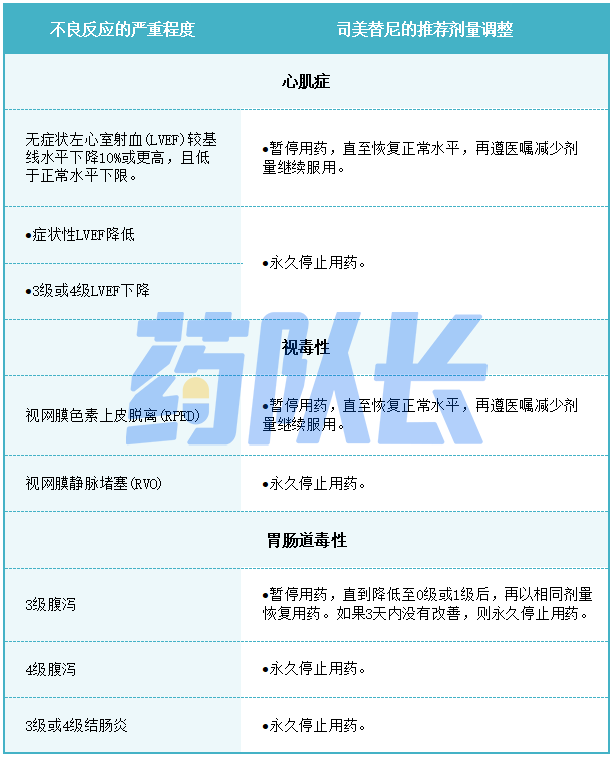
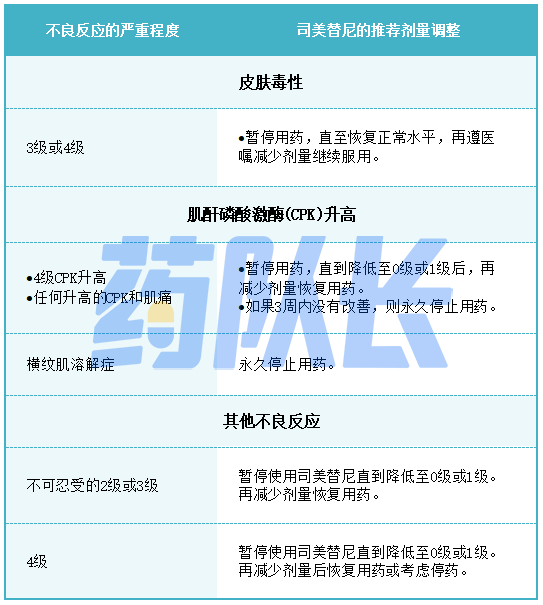
表2提供了不良反应的建议剂量减少量。
表2司美替尼不良反应的推荐减少剂量
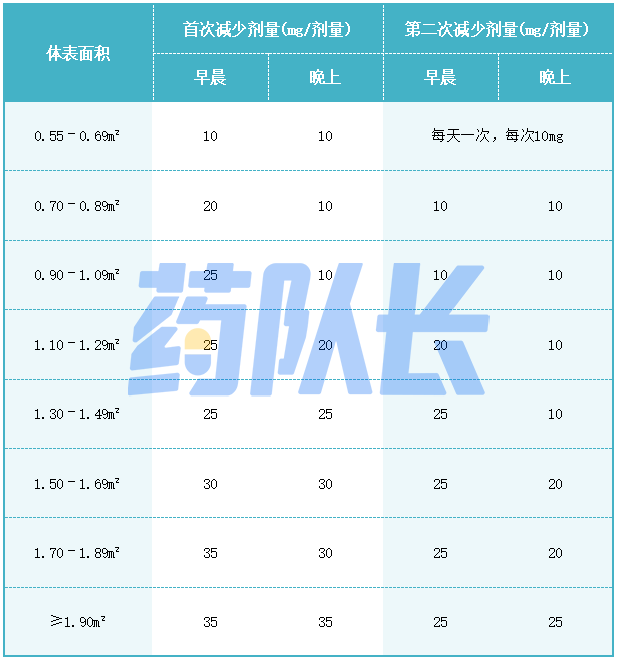
表3针对不良反应的司美替尼推荐剂量调整
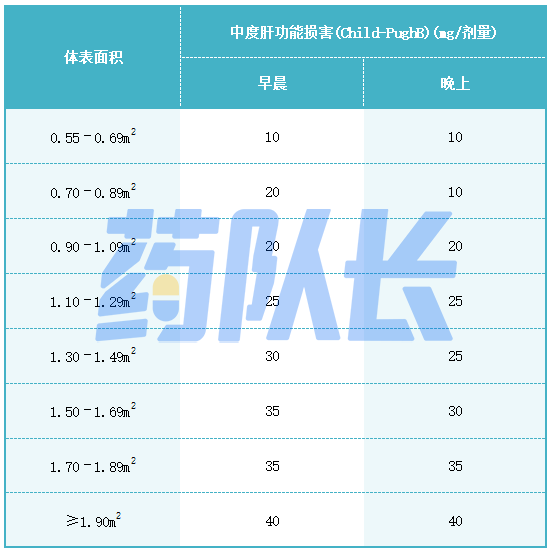
3.肝功能损害的剂量调整
中度肝功能损害患者可将司美替尼的推荐剂量降低至20mg/m²,每日口服两次(Child-PughB)。严重肝功能损害患者(Child-PughC)的司美替尼的推荐剂量尚未确定。
表4中度肝损伤的司美替尼推荐剂量
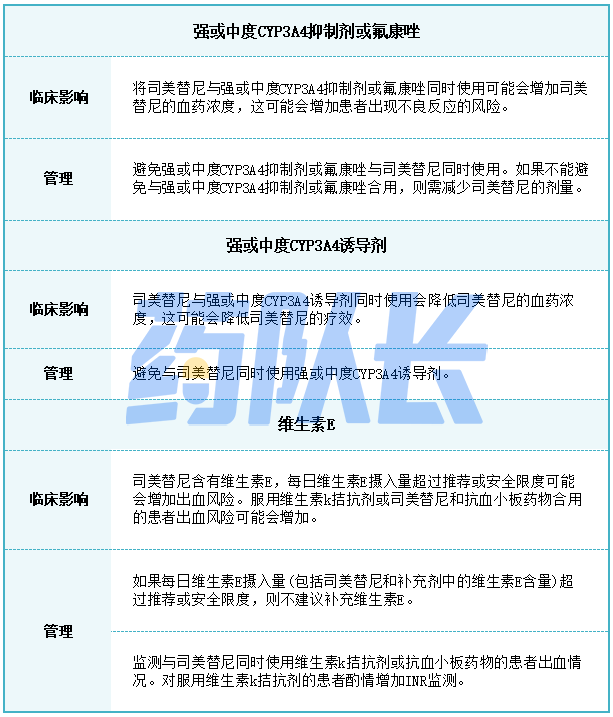
4.药物相互作用的剂量调整
强效或中度CYP3A4抑制剂或氟康唑
避免将强效或中度CYP3A4抑制剂或氟康唑与司美替尼同时服用。如果不能避免与强效或中度CYP3A4抑制剂或氟康唑合用,则按照表5的建议减少司美替尼的剂量。停药后的强效或中度CYP3A4抑制剂或氟康唑3个清除半衰期,恢复在开始使用抑制剂或氟康唑前服用的司美替尼剂量。
表5与强效或中度CYP3A4抑制剂或氟康唑合用时的司美替尼推荐剂量
(三)适用人群
适用于2岁及以上患有1型神经纤维瘤病(NF1)与无法手术的盆状神经纤维瘤患者。
(四)禁忌症
尚未明确。
(五)副作用
最常见的不良反应(≥40%)是:呕吐、皮疹(全部)、腹痛、腹泻、恶心、皮肤干燥、疲劳、肌肉骨骼疼痛、发热、痤疮样皮疹、口炎、头痛、甲沟炎和瘙痒。
(六)注意事项
1.心肌症
心肌症是指左心室射血分数(LVEF)低于基线≥10%。开始治疗前、治疗第一年每3个月、治疗之后每6个月以及根据患者临床指征,通过超声心动图评估射血分数。再根据不良反应的严重程度,暂停、减少剂量或永久停用司美替尼。对于因LVEF降低而中断司美替尼治疗的患者,每3至6周进行一次超声心动图或心脏MRI检查。当LVEF下降到大于或等于LLN时,每2至3个月或按照心脏病专家的指示进行超声心动图或心脏MRI检查。
2.视毒性
在未经批准的多种肿瘤类型的成人患者中,使用司美替尼作为单一药物或与其他抗癌药物联合使用司美替尼时出现了严重的视毒性,包括视网膜静脉阻塞(RVO)和视网膜色素上皮脱离(RPED)。在使用单药司美替尼治疗期间,儿科人群中出现RPED,并导致永久停药。在开始使用司美替尼之前,在治疗期间定期进行全面的眼科评估,并评估新的或恶化的视力变化。RVO患者应永久停用司美替尼。对RPED患者中停用司美替尼,需要每3周随访一次光学相干断层扫描评估直到消退,并减少司美替尼的剂量。对于其他视毒性,可根据不良反应的严重程度暂停、减少剂量或永久停用司美替尼。
3.胃肠毒性
在一个未经批准的患有多种肿瘤类型的成年患者群体中,接受单一药物或与其他抗癌药物联合使用司美替尼的患者出现了严重的胃肠道毒性反应。包括穿孔、结肠炎、肠梗阻和肠梗阻,结肠炎发生在未经批准的接受单一药物司美替尼治疗的多种肿瘤类型的儿童患者人群中。
建议患者在首次出现未形成的稀便后立即开始服用抗腹泻药物(如洛哌丁胺),并在腹泻期间增加液体摄入量。根据不良反应的严重程度,暂停、减少剂量或永久停用司美替尼。
4.皮肤毒性
其他皮肤毒性,包括严重的手掌-足底红细胞感觉异常综合征,发生在未经批准的患有多种肿瘤类型的成年患者中,这些患者将接受司美替尼作为单一药物或与其他抗癌药物联合使用。
监测严重的皮疹。根据不良反应的严重程度,暂停、减少剂量或永久停用司美替尼。
5.肌酐磷酸激酶升高
在一个未经批准的接受司美替尼单药治疗的成年人人群中发生了横纹肌溶解。在开始使用司美替尼前,根据临床指征在治疗期间定期获得血清CPK,如果CPK升高,请评估患者是否患有横纹肌溶解症或其他原因。再根据不良反应的严重程度,暂停、减少剂量或永久停用司美替尼。
6.维生素E水平和出血风险增加
与司美替尼同时服用维生素k拮抗剂或抗血小板拮抗剂的患者出血风险可能增加。监测这些患者的出血情况。在服用维生素k拮抗剂的患者中酌情增加国际标准化比率(INR)监测。
更频繁地进行抗凝血评估,包括INR或凝血酶原时间,并酌情调整维生素K拮抗剂或抗血小板药物的剂量。
7.胚胎-胎儿毒性
孕妇服用司美替尼可能会对胎儿造成伤害。需要告知孕妇司美替尼对胎儿的潜在风险。建议有生殖潜力的女性在使用司美替尼治疗期间和最后一次服药后1周内使用有效避孕措施。建议有生殖潜力的女性伴侣的男性在司美替尼治疗期间和最后一次给药后1周内使用有效避孕措施。
(七)治疗效果
1、试验设计
这是一项平行的II期研究,塞美替尼最近被批准用于治疗1型神经纤维瘤病(NF1)儿童中无法手术的症状性丛状神经纤维瘤(PN)。这项研究确定了NF1PN儿童对司美替尼(selumetinib)的反应率,
2、试验结果的设定
患有NF1和无法手术的PN的儿童接受司美替尼25mg/m²口服,每天两次(1个周期=28天)。体积磁共振成像分析和结果评估,包括患者报告(PRO)、观察者报告和功能结果测量,持续2年每4个周期进行一次,并评估随时间的变化。确认的部分缓解(cPR)定义为间隔≥3个月的至少2次连续扫描中PN体积减少≥20%。
3、试验结果
72%的受试者在司美替尼治疗后出现cPR。在数据截止时,参与者接受司美替尼治疗的中位数为41个周期(最少2个周期,最多67个周期)。大约一半的儿童在基线时有一些目标肿瘤疼痛,到第13个周期前明显减轻。司美替尼导致大多数NF1PN受试者的PN缩小,但没有临床显着的发病率。服用司美替尼期间没有出现新的PN相关症状,PRO测量表明肿瘤相关疼痛强度下降。这表明司美替尼治疗可以预防PN相关疾病的发生,不过还需要未来的前瞻性研究来证实这些结果。
(八)药物相互作用
其他药物对司美替尼的影响
(九)储存条件
25°C(77°F)保存,偏差允许在15°C至30°C(59°F至86°F)。
使用时在原瓶中分发,不要去除干燥剂,防止受潮。
【温馨提示】:部分商品说明书更换频繁,请以商品实物为准。

司美替尼适用于2岁及以上患有1型神经纤维瘤病(NF1)且有症状且不能手术的丛状神经纤维瘤(PN)的儿科患者的治疗。






