2023年5月12日,Veozah(fezolinetant)获美国药监局(FDA)批准在美国上市,用于治疗更年期相关的中度至重度血管舒缩症状(VMS)—更年期中重度潮热,基于这一事件,任职于FDA的医学博士Janet Maynard表示,Veozah将为女性提供一种全新的、安全有效的治疗选择。
医学博士Janet Maynard
更年期潮热治疗现况
据2021年第七次人口普查统计,我国女性人口约为6.88亿,处于更年期女性约有2亿,其中有1.5亿以上女性饱受更年期综合征的困扰。而潮热是更年期女性最为典型的症状,因雌激素水平发生波动或锐减,导致女性植物神经功能紊乱,影响血管舒缩和机体热调节功能,这类患者会反复出现持续数分钟的出汗、潮红和发冷,并感到焦虑不安,对女性造成了严重的心理和身体负担。
更年期潮热示意图(图源于网络 侵权请告知)
目前更年期潮热主要依靠激素进行治疗,但伴有阴道流血、严重肾功能不全,或患有乳腺癌、血卟啉症、耳硬化症等疾病的女性,不能接受激素治疗,而Veozah的上市,适时地填补了这一治疗空缺。
FDA首款NK3受体拮抗剂—Veozah横空出世!
Veozah由日本安斯泰来制药公司研发,是首款被 FDA 批准用于治疗更年期中度至重度潮热的神经激肽3 (NK3)受体拮抗剂,NK3受体可调节体温,该药通过结合并阻断NK3受体的活动发挥作用,是一种非激素疗法。其作用机制是通过阻断神经激肽B(NKB)和Kisspeptin(亲吻素)/神经激肽B(NKB)/强啡肽(KNDy)神经$的结合,以调节体温调节中枢,降低潮热的严重程度和发生频率。
Veozah实拍图
数据亮相!Veozah显著降低中重度血管舒缩症状的发生频率和严重程度
Veozah获批基于BRIGHT SKY研究的临床数据,该研究共包含SKYLIGHT 1和SKYLIGHT 2两项临床试验,其中SKYLIGHT 1试验评估了Veozah治疗与更年期相关的中度至重度血管舒缩症状的安全性和疗效,患者随机分为三组,分别予以安慰剂、Veozah30mg和Veozah45mg治疗。
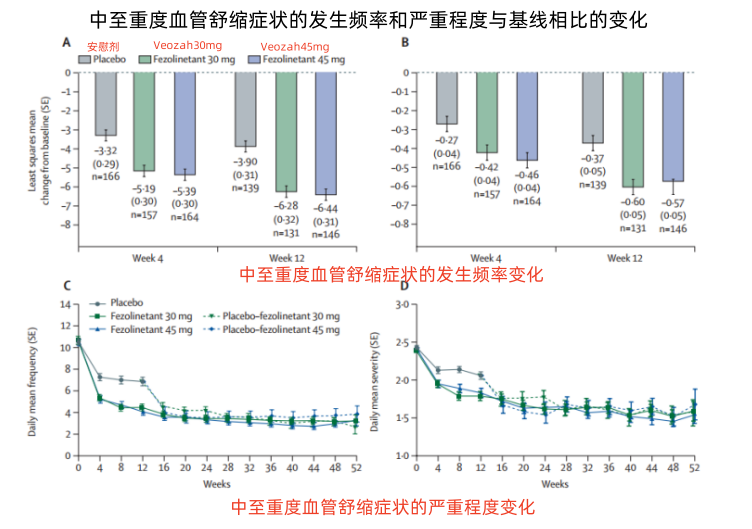
中至重度血管舒缩症状的发生频率和严重程度与基线相比的变化(图源于网络 侵权请告知)
试验结果显示,相较于安慰剂组,Veozah低剂量组和Veozah高剂量组第4周和第12周的血管舒缩症状发生频率和严重程度显著降低,并且在接受治疗后1 周,就可观察到血管舒缩症状的发生频率和严重程度的改善,持续时间超过52周。
在治疗的前12周内,Veozah低剂量组和Veozah高剂量组分别有37%和43%的患者发生治疗相关的不良反应,均低于安慰剂组的45%。SKYLIGHT 1试验证实该药可显著降低中重度血管舒缩症状的发生频率和严重程度,因此用于中重度潮热患者可临床获益。
注意!肝损患者请慎用
Veozah的临床疗效良好,但其具有肝脏毒性,可能会导致转氨酶水平升高和肝脏损伤,因此患有肝硬化、严重肾损伤或终末期肾病的患者禁用。
此外,在开始用药后第3、6、9个月,应对患者的肝功能进行监测,小编温馨提示,若患者发生恶心、呕吐或皮肤和眼睛发黄等,与肝脏损伤相关的症状,一定要及时告知医生,若患者血清转氨酶浓度≧正常值上限(ULN)的两倍,则不要开始治疗,毕竟安全用药才是获得疗效的前提!
免责声明: 以上内容整理于FDA说明书、DRUGS及网络,仅作信息交流之目的,文中观点不代表药队长立场,亦不代表药队长支持或反对文中观点。本文也不是治疗方案推荐。页面内容仅供医学药学专业人士阅读参考,具体用药请咨询主治医师,本站只做信息展示,不销售药品。如需获得治疗方案指导,请前往正规医院就诊。
参考资料: https://www.accessdata.fda.gov/scripts/cder/daf/index.cfm