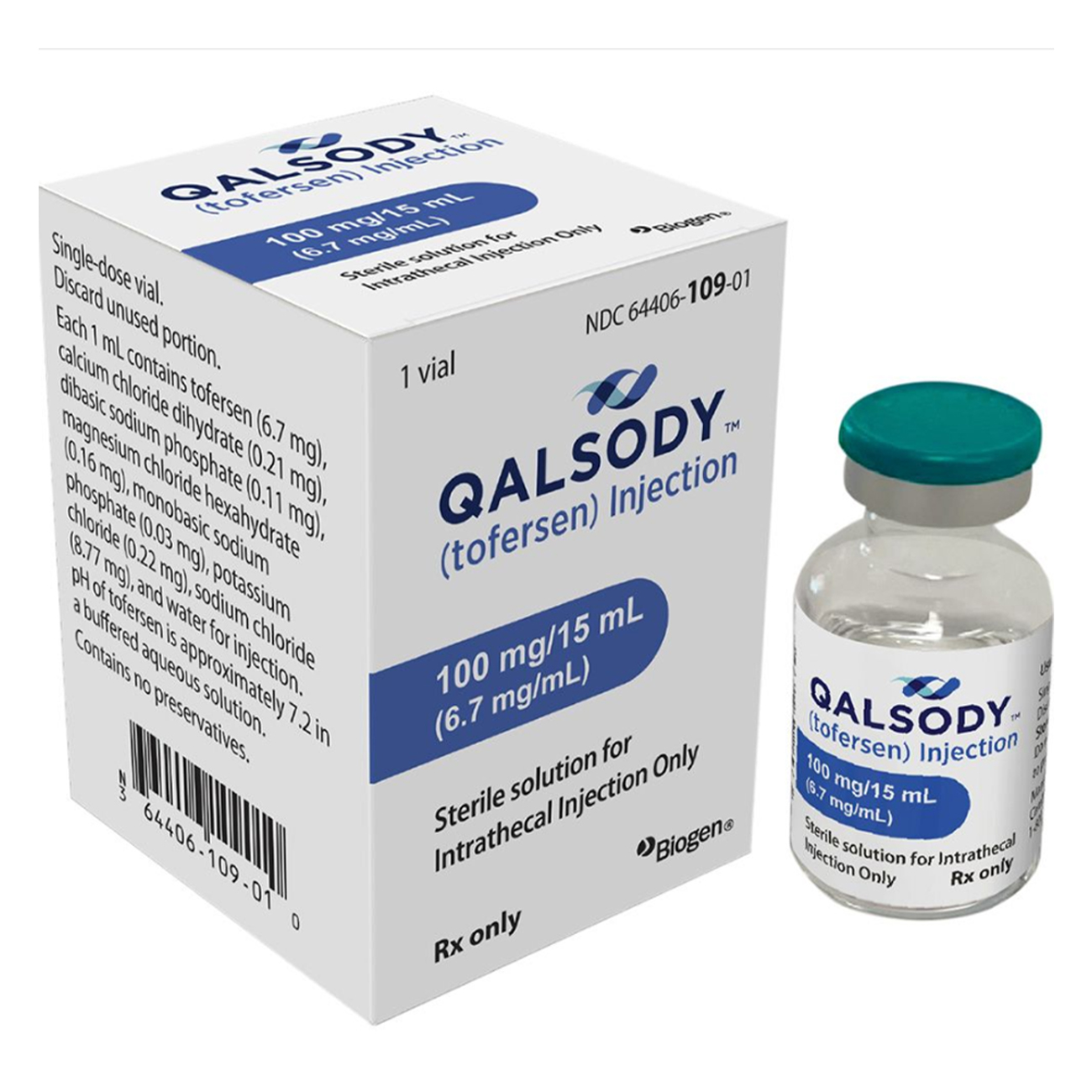
托夫生(Qalsody)
温馨提示:图片来自公开渠道(如FDA官网、Drugs官网、原研药厂官网等),仅供参考。
- 药品百科
- 治疗效果
- 用法用量
- 副作用
- 注意事项
- 药物相互作用
适用于治疗患有超氧化物歧化酶1(SOD1)基因突变的成人肌萎缩侧索硬化症(ALS)。
澄清、无色至微黄色的溶液,装于单剂量I型玻璃瓶中,不含防腐剂。
托夫生通过鞘内注射(腰椎穿刺)给药,应由具备腰穿经验的医疗专业人员或在其指导下操作。
推荐剂量每次100毫克(15毫升)。负荷期每14天给药1次,共3次。负荷期结束后,每28天给药1次。
漏服剂量处理:漏第二次负荷剂量:尽快补种,补种后14天给第三次负荷剂量。
漏第三次负荷剂量或维持剂量:尽快补种,补种后28天给下一剂。
制备:药瓶冷藏取出后自然回温,不得加热或摇晃;溶液异常勿用。
给药:先抽取约10毫升CSF,再抽取15毫升药液;不稀释、不过滤,经腰穿针1–3分钟缓慢推注。
时限:不含防腐剂,抽入注射器后须立即使用(4小时内),剩余弃去。
常见不良反应包括:疼痛(含背部疼痛、肢体疼痛)、疲劳、关节痛、脑脊液白细胞增多、肌痛。
其他不良反应包括:脑脊液蛋白增加、肌肉僵硬、神经痛。
严重不良反应包括:脊髓炎和/或神经根炎、视乳头水肿和颅内压升高、无菌性脑膜炎。
在长期扩展研究中,重复给药后曾报告非严重的发热反应。
1.脊髓炎和/或神经根炎
2.视乳头水肿和颅内压升高
3.无菌性脑膜炎
【孕妇】目前尚无足够数据评估孕妇使用托夫生相关的发育风险。
【哺乳期女性】尚无托夫生或其代谢物是否存在于人乳中、对母乳喂养婴儿的影响或对乳汁分泌影响的数据。应权衡母乳喂养对发育和健康的益处、母亲对托夫生的临床需求以及托夫生或母体基础疾病对母乳喂养婴儿的任何潜在不良影响。
【具有生殖潜力的男性和女性】在动物实验最高测试剂量下观察到对雄性生殖器官的不良影响(生精小管变性、生精小管扩张、精子细胞滞留、上皮细胞凋亡、睾丸细胞碎片增加、附睾精子减少),但未对功能性终点产生不良影响。
【儿童使用】尚未确定在儿科患者中的安全性和有效性。
【老年人使用】在老年患者与年轻患者之间未观察到安全性或有效性的总体差异,但不能排除部分老年人敏感性更高。给药时无需基于年龄进行特殊剂量调整。
【肾功能损害】尚未进行临床研究评估托夫生在肾功能损害患者中的药代动力学。说明书中尚未明确具体用药指导。
【肝功能损害】尚未进行临床研究评估托夫生在肝功能损害患者中的药代动力学。预计托夫生不经肝酶代谢。说明书中尚未明确具体用药指导。
未进行临床药物相互作用研究。体外研究表明,托夫生不是主要细胞色素P450(CYP)酶的底物、抑制剂或诱导剂,也不是主要转运蛋白的底物或抑制剂。预计与经这些途径代谢或转运的药物发生有临床意义的相互作用的可能性较低。
- 公开资料参考价
- 药品概述
- 药品信息
-
【少儿多动症】高蛋白饮品
[适应症]少儿多动症[试验分期]
-
【帕金森】BBM003注射液
[适应症]帕金森[试验分期]Ⅰ期
-
【偏头痛】Zavegepant鼻喷雾剂
[适应症]成人有或无先兆偏头痛的急性期治疗[试验分期]Ⅲ期
-
【癫痫】布立西坦片
[适应症]癫痫[试验分期]Ⅲ期