温馨提示: 药品图片来自网络,仅供参考;如遇新包装上市可能存在上新滞后,请以实物为准,如有侵权,请联系删除。
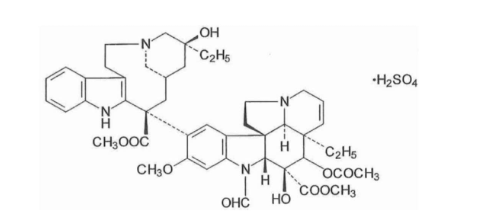
主要活性成分是硫酸长春新碱,化学结构式:
一、用法
仅供静脉使用,如果通过其他途径给药,则会导致死亡。
二、推荐剂量
推荐剂量为2.25 mg/m2,1小时内完成静脉给药,每7天一次。
三、制备
硫酸长春新碱脂质体注射液属于危险药物,遵循适用的特殊处理和处置程序。
因为硫酸长春新碱脂质体注射液中不含任何防腐剂或抑菌剂,因此必须严格遵守无菌技术,涉及混合磷酸钠注射液、鞘磷脂/胆固醇脂质体注射液和硫酸长春新碱注射液必须在生物安全柜中或按照已确立的药房安全程序制备无菌注射剂和危险药物。但是涉及将小瓶置于水浴中的制备步骤必须在无菌区域外进行。请勿与串联过滤器一同使用,不得与其他药物混合。
水浴过程:
1.将水槽注满水,从底部测量,距离至少为8 cm(3.2英寸),并在整个过程中保持该最低水位。水浴必须保持在无菌区域外。
2.将经校准的温度计置于水浴中以监测水温,并将其留在水浴中直至程序完成。
3.将水浴预热至63°C~67°C,保持该水温,直到使用校准温度计完成程序。
4.在溶液和容器允许的情况下,制备前目视检查硫酸长春新碱脂质注射液各小瓶是否存在不溶性微粒和变色,如果存在沉淀或异物,请勿使用。
5.取下小瓶上的所有瓶盖,并用无菌酒精棉片擦拭小瓶。
6.在生物安全柜中,使用配备有无菌0.2微米过滤器或其他合适排气装置的无菌排气针头对磷酸钠注射液小瓶进行排气,始终定位排气针,在加入鞘磷脂/胆固醇脂质体注射液和硫酸长春新碱注射液前,应指向远高于液面。
7.抽取1 mL鞘磷脂/胆固醇脂质体注射液。
8.将1 mL鞘磷脂/胆固醇脂质体注射液注入磷酸钠注射液小瓶中。
9.抽取5 mL硫酸长春新碱注射液。
10.将5 mL硫酸长春新碱注射液注入磷酸钠注射液小瓶。
11.取下排气针头,轻轻倒置磷酸钠注射液小瓶5次,混匀。请勿摇晃。
12.将漂浮环套在磷酸钠注射液小瓶的颈部。
13.使用经校准的温度计确认水浴温度为63℃~67℃。取出含有硫酸长春新碱注射液的磷酸钠注射液小瓶,从生物安全柜中取出鞘磷脂/胆固醇脂质体注射液和磷酸钠注射液,并使用校准的电子计时器将其放入水浴中10分钟,监测温度,确保温度维持在63°C~67°C。
14.将磷酸钠注射液瓶放入水浴后,立即在硫酸长春新碱脂质体注射液外标签上记录开始配制时间和水温。
15.使用水浴10分钟后,使用经校准的温度计确认水温为63℃~67℃,从水浴中取出小瓶(使用钳子防止灼伤),取出浮动环。
16.在硫酸长春新碱脂质体注射液外标签上记录最终复溶时间和水温。
17.用干净的纸巾擦干磷酸钠注射液瓶的外部,粘贴Marqibo(硫酸长春新碱脂质体注射液)的外标签,轻轻颠倒5次混匀。请勿摇晃。
18.允许复溶小瓶内容物在受控室温(15℃~30℃)下平衡至少30分钟。
19.Marqibo(硫酸长春新碱脂质体注射液)含5 mg/31 mL(0.16 mg/mL)硫酸长春新碱,制备后,在受控室温(15℃~30℃,59℉~86℉)下储存不超过12小时。
20.使用无菌酒精棉片擦拭含有硫酸长春新碱脂质体注射液的药瓶顶部,并将药瓶放回生物安全柜。
21.根据患者的实际体表面积(BSA)计算患者的硫酸长春新碱脂质体注射液剂量,从含 100 mL 5% 葡萄糖注射液或0.9%氯化钠注射液的输液袋中抽取相当于患者硫酸长春新碱脂质体注射液剂量的体积。
22.将硫酸长春新碱脂质体注射液剂量注入输液袋中,使最终体积达到100 mL。
23.在输液袋标签上填写所需信息,并贴在输液袋上。
24.硫酸长春新碱脂质体注射液制备开始后12小时内,完成稀释产品给药。
25.每次使用后清空、清洁并干燥水浴。
26.温度、时间和制备程序的偏差可能无法确保将硫酸长春新碱适当包封至脂质体中。如果制备偏离上述步骤的说明,应丢弃药盒中的组件,并使用新的药盒制备剂量。
最常见的不良反应(发生率≥30%)是便秘、恶心、发热、疲劳、周围神经病变、发热性中性粒细胞减少症、腹泻、贫血、食欲下降和失眠。
一、仅用于静脉注射
如果通过其他途径给药会致命,鞘内给药则会导致死亡,此外在制备和给药前核对药物名称和剂量,以免用药过量。
二、外渗组织损伤
外渗会导致组织损伤,只能通过安全且自由流动的静脉接入管给药,怀疑外渗应立即停药并采取措施。
三、神经毒性
治疗期间可能会出现神经毒性,包括反射减退、神经痛等,已经有严重神经病变的患者应在仔细评估风险效益后进行使用,根据病情严重程度中断或停止本品的使用。
四、骨髓抑制
使用本品可能会导致中性粒细胞计数和血小板减少和贫血,使用本品前应监测全血细胞计数。
五、肿瘤溶解综合征
使用本品可能会导致肿瘤溶解综合征,应进行适当的监测。
六、便秘和肠梗阻
使用本品可能会导致便秘,应考虑足够膳食纤维摄入以及大量饮水。
七、乏力
会导致严重的疲劳,考虑减少剂量或停药。
八、肝毒性
使用过程中监测肝功能。
九、胚胎-胎儿毒性
告知孕妇对胎儿的潜在毒性,建议具有生殖潜力的女性在接受本品治疗期间以及最后一次给药后6个月内采取有效避孕措施。
建议具有生殖潜力的男性在接受本品治疗期间以及最后一次给药后采取有效避孕措施,至少持续3 个月。
(以上内容参考自美国FDA硫酸长春新碱脂质体2022.03版说明书)
免责声明: 以上内容整理于FDA说明书、DRUGS及网络,仅作信息交流之目的,文中观点不代表药队长立场,亦不代表药队长支持或反对文中观点。本文也不是治疗方案推荐。页面内容仅供医学药学专业人士阅读参考,具体用药请咨询主治医师,本站只做信息展示,不销售药品。如需获得治疗方案指导,请前往正规医院就诊。
参考资料: https://www.accessdata.fda.gov/scripts/cder/daf/index.cfm。
- 药品知识
- 药品信息
- 白血病常用药汇总(二)CPX-351 双药脂质体、长春新碱 本文根据最新的急性髓细胞白血病NCCN诊疗指南2022.02版,介绍了...[ 详情 ]推荐指数:546 2023-04-13
-
【青光眼或高眼压症】DE-117B滴眼液
[适应症]原发性开角型青光眼或高眼压症[试验分期]Ⅲ期
-
【肝功能不全】LH-1801片
[适应症]肝功能不全[试验分期]Ⅰ期
-
【系统性红斑狼疮】C-CAR168细胞回输注射液
[适应症]系统性红斑狼疮[试验分期]Ⅱ期
-
【复发脑胶质瘤】GNC-039四特异性抗体注射液
[适应症]复发脑胶质瘤(病理确诊为四级星型细胞瘤和四级胶质母细胞瘤)[试验分期]Ⅰ期