温馨提示: 药品图片来自网络,仅供参考;如遇新包装上市可能存在上新滞后,请以实物为准,如有侵权,请联系删除
本品活性成份为索凡替尼
化学名称:N-[2-(二甲基氨基)乙基]-1-[3-({4-[(2-甲基-1H-吲哚-5-基)氧基]嘧啶-2- 基}氨基)苯基] 甲磺酰胺
化学结构式:
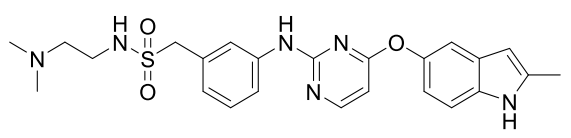
分子式:C24H28N6O3S
分子量:480.59
本品应在有肿瘤治疗经验的医生指导下使用。
推荐剂量和服用方法
每次300 mg(6粒),每日1次;连续服药(每4周为一个治疗周期)。本品可随低脂餐(500千卡,约20%脂肪)同服或空腹口服,需整粒吞服。建议每日同一时段服药,如果服药后患者呕吐,无需补服;漏服剂量,不应在次日加服,应按常规服用下一次处方剂量。
治疗时间
按治疗周期持续服药,直至疾病进展或出现不可耐受的毒性。
剂量调整
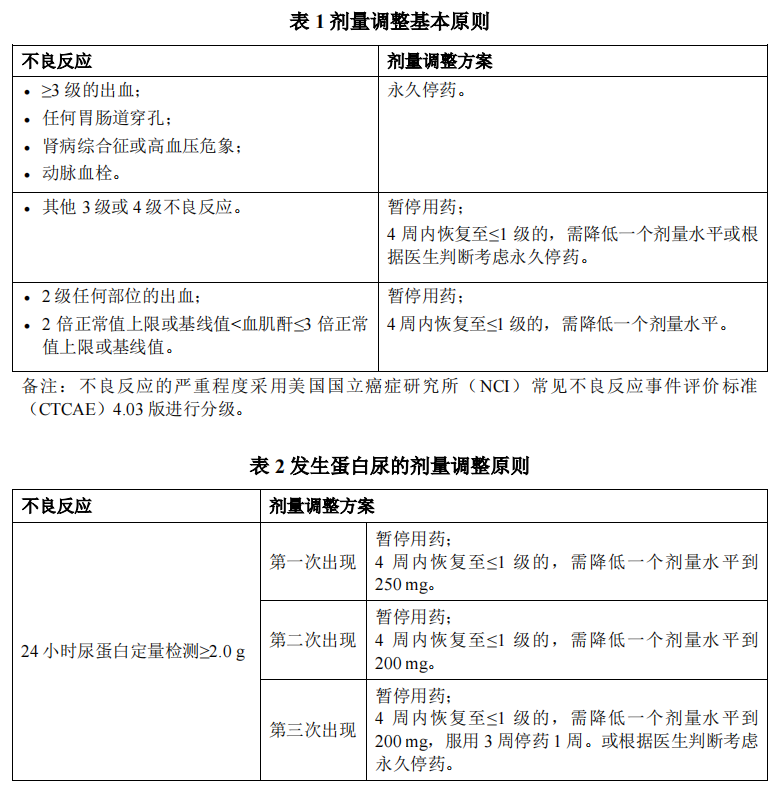
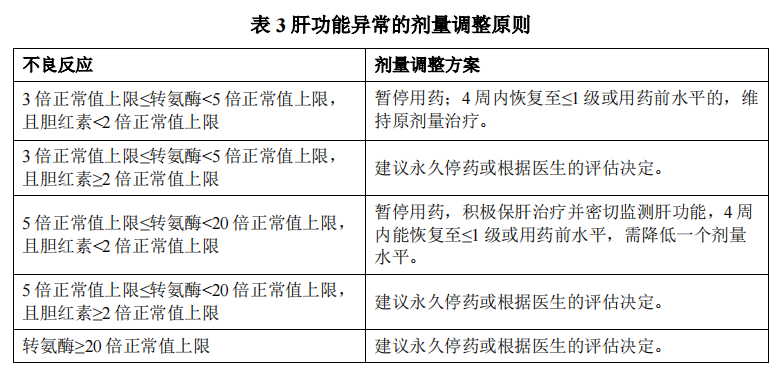
在用药过程中医生应密切监测患者,根据患者个体的安全性和耐受性调整用药,包括暂停用药、降低剂量或永久停用本品。剂量调整应遵循“先暂停用药再下调剂量”的原则。暂停用药后,如4周内不良反应恢复至≤1级,建议在医生指导下调整剂量:第一次剂量调整至每日250 mg(5粒);第二次剂量调整至每日200 mg(4粒);若仍不耐受,则可以考虑200 mg每日一次服药3周停药1周或永久停药。剂量调整基本原则见表1;针对蛋白尿的剂量调整原则见表2;针对肝功能异常的剂量调整原则见表3。
特殊患者人群
肝功能不全患者
目前尚无本品对肝功能不全患者影响的相关数据,轻中度肝功能不全患者须在医生指导下慎用本品并严密监测肝功能,重度肝功能不全患者禁用。
肾功能不全患者
目前尚无本品对肾功能不全患者影响的相关数据,轻度肾功能不全患者无需调整起始剂量,中重度肾功能不全患者须在医生指导下慎用本品。
在 718 例患者中,发生率≥20%不良反应包括:蛋白尿、高血压、血胆红素升高、腹泻、血白蛋白降低、血甘油三酯 升高、血促甲状腺激素升高、疲乏/乏力、腹痛、外周水肿、血尿酸升高、出血。
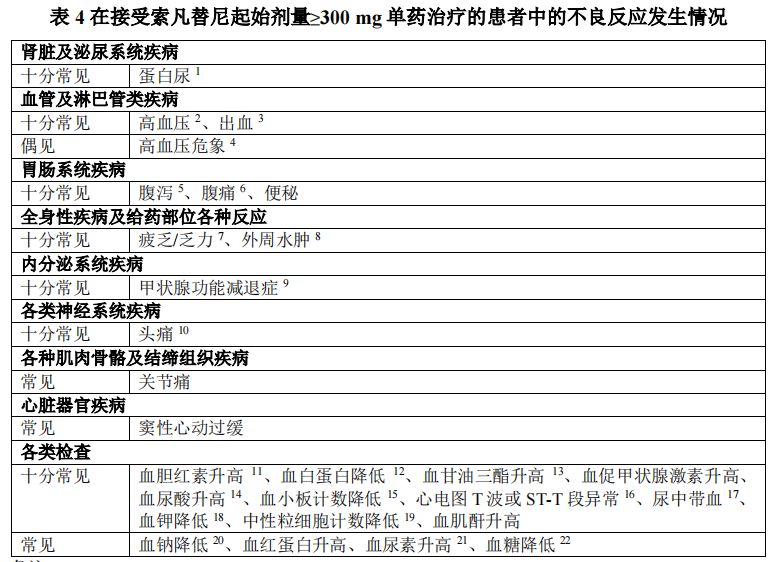
重要不良反应
肝脏功能异常
在718例接受索凡替尼单药治疗起始剂量≥300 mg的患者中,肝脏功能异常主要表现为血胆红素升高、天门冬氨酸氨基转移酶升高及丙氨酸氨基转移酶升高,多为1~2级,常在服药后3周出现;≥3级事件的发生率为12.8%,因肝脏功能异常而永久停药的发生率为3.5%,因肝脏功能异常而暂停用药的发生率为7.1%,因肝脏功能异常而减量用药的发生率为2.8%,有1例(0.1%)患者因肝损伤死亡。
出血
在718例接受索凡替尼单药治疗起始剂量≥300 mg的患者中,出血主要表现为血尿、胃肠出血及牙龈出血,多为1~2级,常在服药后4周出现;≥3级事件的发生率为4.5%,主要为胃肠出血(1.9%)和脑出血(1.1%),有致死性病例,各0.3%;因出血而永久停药的发生率为2.6%,因出血而暂停用药的发生率为3.8%,因出血而减量用药的发生率为1.4%。高血压
在718例接受索凡替尼单药治疗起始剂量≥300 mg的患者中,高血压多为1~2级,常在服药后2周出现;≥3级事件的发生率为29.7%,有1例(0.1%)高血压急症和1例(0.1%)高血压危象;因高血压而永久停药的发生率为1.1%,因高血压而暂停用药的发生率为5.7%,因高血压而减量用药的发生率为5.3%。
蛋白尿
在718例接受索凡替尼单药治疗起始剂量≥300 mg的患者中,蛋白尿多为1~2级,常在服药后4周出现;≥3级事件的发生率为14.5%,因蛋白尿而永久停药的发生率为3.1%,因蛋白尿而暂停用药的发生率为12.8%,因蛋白尿而减量用药的发生率为15.6%。
肝脏功能异常
临床研究中观察到本品可能引起血胆红素升高、转氨酶升高及肝脏功能异常,并有肝损伤致死病例报道(见【不良反应】)。
在本品用药前需检测肝功能(转氨酶和胆红素),治疗的前两个月建议每两周监测肝功能,之后每月或根据临床需要监测肝功能。当患者在用药期间出现转氨酶升高或胆红素升高或其它肝损伤的临床表现时,应及时暂停、减量或停用本品,积极实施保肝处理并提高肝功能监测频率至每周一次或两次,直至转氨酶和/或胆红素恢复到≤1级或用药前水平(见【用法用量】)。
因本品尚无肝功能不全患者的临床数据,轻中度肝功能不全患者须在医生指导下慎用本品并严密监测肝功能,重度肝功能不全患者禁用。
出血
临床研究中观察到本品可导致出血或增加出血的风险,有出血导致死亡病例报道(见【不良反应】)。
服用本品的患者应关注用药后的出血症状和体征,包括体表出血点、淤血,口腔牙龈等部位出血以及咯血等,将出血情况及变化及时报告医生。
临床医生用药时应密切关注患者出血风险,定期监测患者的血常规和凝血指标,尤其对在治疗期间需服用抗血小板、抗凝、抗血栓及其他可能增加出血风险药物的患者,需增加血小板及凝血指标的监测频率。
一旦患者出现需要紧急医学干预或≥3级的出血,应立即停用本品并及时就医(见【用法用量】)。
高血压
临床研究中观察到本品可导致高血压,有高血压危象的病例报告(见【不良反应】)。
临床研究中,血压经过标准抗血压治疗通常可得到良好的控制。3级的高血压经过积极降血压处理或剂量调整后可恢复至≤1级或用药前水平。
在本品用药前和用药期间需将患者血压控制至140/90mmHg以内;治疗期间需常规监测血压,有临床症状时可增加血压测量频率,对于剂量暂停或减量后血压控制不佳者,建议就医调整降压药物或停止本品治疗,避免高血压危象。
蛋白尿
临床研究中观察到本品可增加蛋白尿的风险。(见【不良反应】)
临床研究中,3级的蛋白尿经过剂量调整(见【用法用量】)及积极对症处理可恢复至1级或用药前水平。
本品用药期间,患者需定期检查尿常规,必要时进行24小时尿蛋白定量检查。当本品用于肾功能不全患者时,应密切监测尿蛋白和肾功能。
肾功能损伤
临床研究中观察到本品可增加肾功能损伤(包括急性肾功能损伤、肾衰、肾病综合征等)的风险,尚无5级事件的病例报告。(见【不良反应】)
在本品用药前需检测尿常规和肾功能(血肌酐和尿素氮/尿素),治疗期间需定期监测尿常规和肾功能。当患者在用药期间出现血肌酐升高2倍以上或尿量减少时,应及时暂停、减量或停用本品。(见【用法用量】)
因本品尚无中重度肾功能不全患者的临床数据,中重度肾功能不全患者应慎用本品。
动脉血栓/静脉血栓
单药治疗的临床研究中观察到动脉血栓或静脉血栓事件的病例报告。
在本品治疗期间,需严密关注有动静脉血栓高风险因素(包括老龄、长期卧床、高血压、糖尿病、心肌缺血及梗死、脑缺血及梗死等)的患者,一旦检查发现动静脉血栓或出现动/静脉血栓或卒中症状需立即停用本品并即刻就医。
可逆性后部脑病综合征
临床研究中观察到可逆性后部脑病综合征(PRES)的单例病例报告,停药后康复。PRES的体征和症状包括癫痫发作、头痛、精神状态改变、视力障碍或皮质盲,伴随或不伴随高血压。PRES的诊断通常需要脑部磁共振成像(MRI)证实。对于疑似PRES的患者,应停用本品,对其他医学症状积极采取支持性医学措施。
胃肠道穿孔
胃肠道穿孔是消化道恶性肿瘤患者重要的并发症。在单药治疗的临床研究中观察到胃肠穿孔和腹膜炎的病例报告。
在本品治疗期间,需严密关注存在胃肠道穿孔风险的患者,如疑似出现或已发生胃肠穿孔应立即停用本品,及时救治。突发的上腹部剧烈疼痛、呈持续性刀割样、烧灼样痛,并扩散到全腹等是消化道穿孔的常见症状,患者若出现上述症状,应立即停用本品并就医。
对于存在未愈合的胃肠穿孔或消化道瘘的患者,须避免使用本品。
伤口愈合延迟
抗血管生成类药品可能抑制或妨碍伤口愈合,临床研究中观察到单例伤口愈合延迟的病例报告,建议对治疗期间需接受外科手术的患者暂停使用本品。在术后或创伤后,须经医生判断伤口完全愈合后方可恢复本品治疗。
对驾驶和操纵机器的影响
目前尚无关于本品对驾驶或操纵机器的能力影响的研究。如果患者在本品治疗期间出现影响其注意力和反应的症状,建议其在症状消除后再驾驶或操纵机器。
(以上信息来源于 中国药监局药品说明书 2020.12版本)
免责声明: 以上内容整理于FDA、DRUGS、网络,仅作信息交流之目的,文中观点不代表药队长立场,亦不代表药队长支持或反对文中观点。本文也不是治疗方案推荐。页面内容仅供医学药学专业人士阅读参考,具体用药请咨询主治医师,本站只做信息展示,不销售药品。如需获得治疗方案指导,请前往正规医院就诊。
参考资料: 参考FDA说明书https://www.accessdata.fda.gov/scripts/cder/daf/index.cfm
- 药品知识
- 药品信息
-
【青光眼或高眼压症】DE-117B滴眼液
[适应症]原发性开角型青光眼或高眼压症[试验分期]Ⅲ期
-
【肝功能不全】LH-1801片
[适应症]肝功能不全[试验分期]Ⅰ期
-
【系统性红斑狼疮】C-CAR168细胞回输注射液
[适应症]系统性红斑狼疮[试验分期]Ⅱ期
-
【复发脑胶质瘤】GNC-039四特异性抗体注射液
[适应症]复发脑胶质瘤(病理确诊为四级星型细胞瘤和四级胶质母细胞瘤)[试验分期]Ⅰ期