温馨提示: 药品图片来自网络,仅供参考;如遇新包装上市可能存在上新滞后,请以实物为准。
适用于有骨折高发风险的绝经后妇女骨质疏松症的治疗。本品可显著降低绝经后妇女椎骨和非椎骨骨折风险,但对降低髋骨骨折风险的效果尚未证实。
本品主要成份为特立帕肽
化学结构式:
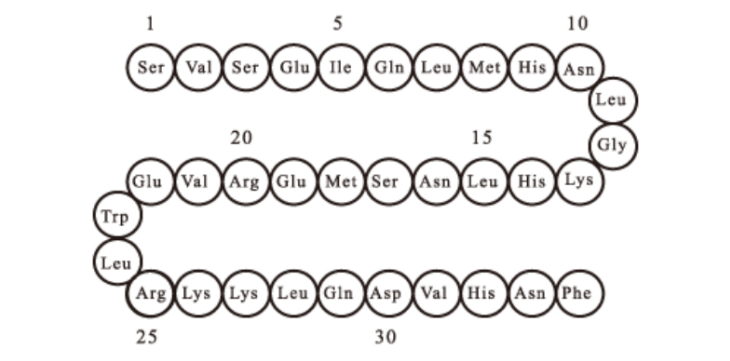
分子式:C181H291N55O51S2
分子量:4117.8 道尔顿
辅料名称:冰醋酸、醋酸钠、甘露醇、间甲酚
本品推荐剂量为每日皮下注射20 微克,注射部位应选择大腿或腹部
应指导患者使用正确的注射方法,本产品为多剂量卡式瓶包装,每天必须使用 指定的笔式注射器进行注射。
本品总共治疗的最长时间为24个月。病人终身仅可接受一次为期24个月的治疗。
如果膳食不能满足需要,患者应当补充钙和维生素 D。
停止使用本品治疗后,患者可以继续其它骨质疏松治疗方法。
肾功能不全患者:本品不得用于严重肾功能不全患者,有中度肾功能不全患者 应慎用本品。
肝功能不全患者:未在肝功能不全患者中进行研究,应在医生指导下慎用。
儿童及开放性骨骺的青少年:本品尚无在小于 18 岁的儿童和青少年中应用的经验。不得用于小于18 岁的儿童、青少年和开放性骨骺的青年。
老年用药:无需根据年龄调整剂量。
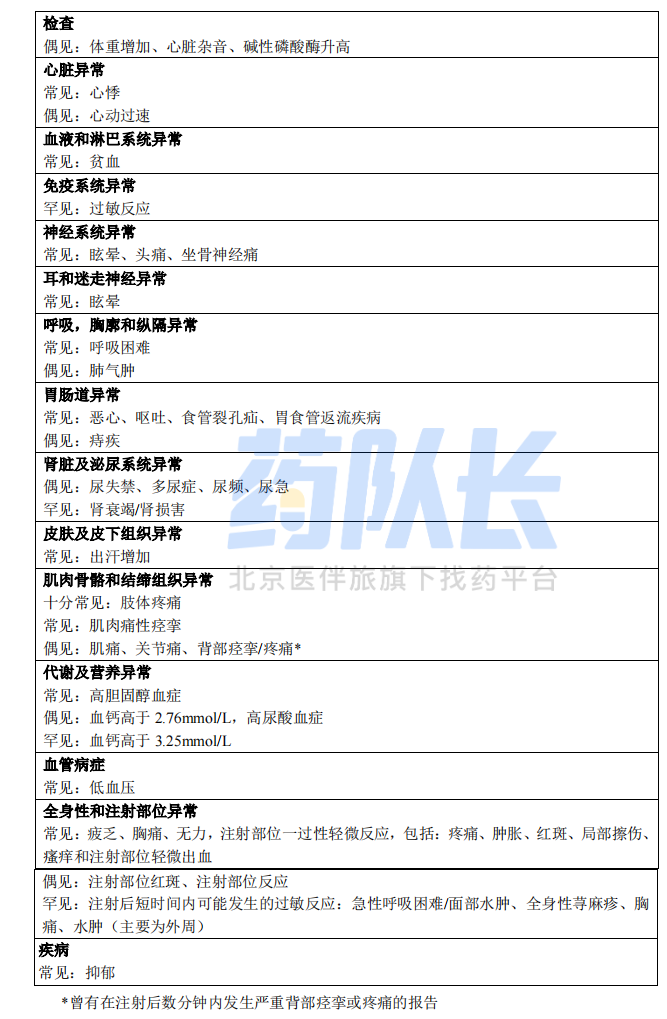
不良反应总结:在接受特立帕肽治疗的患者中最常报告的不良反应有恶心,肢体疼痛,头痛和 眩晕。
不良反应列表:在特立帕肽临床试验中,特立帕肽和安慰剂组中分别有 82.8%和 84.5%的患者 第 2 页/共 11 页报告至少一例不良事件。
下表所列为在治疗骨质疏松的临床研究中和产品上市后,与使用特立帕肽相关的不良反应。
不良反应发生频率的定义如下:十分常见(≥1/10),常见(≥1/100 且<1/10),偶见(≥1/1,000 且<1/100),罕见(≥1/10,000 且<1/1,000),十分罕见 (<1/10,000)。
血钙和尿钙
血钙正常的患者注射特立帕肽后发现血钙浓度有一过性的轻微升高。血钙浓度在注射每剂特立帕肽后4到6小时之间达到峰值并在16到24小时内回到基线水平。因此如果为了监测血钙而采集血样,应在特立帕肽最近一次注射至少16小时后进行。在治疗过程中不需要进行血钙的常规监测。
特立帕肽可能导致尿钙排泄量的轻微升高,但在临床试验中高钙尿的发生率与安慰剂相比没有差异。
尿结石
尚未进行特立帕肽在活动性尿石症患者中应用的研究。因为特立帕肽有加重这种症状的可能,所以在活动性或新发尿石症患者中应慎用。
直立性低血压
在特立帕肽的短期临床研究中,有独立偶发的一过性直立性低血压发作的报告。典型的报告为在注射4小时内发生并在几分钟至数小时后自行恢复。一过性直立性低血压发生于最初几次给药时,患者处于俯卧位后可缓解并且不妨碍继续治疗。
肾功能不全
中度肾功能不全的患者应慎用。
肝功能不全
肝功能不全患者应在医生指导下慎用。
青年人群
包括绝经前妇女在内的青年人群中应用特立帕肽的经验有限。在这类患者中只有获益明显大于风险时才考虑使用特立帕肽。
有生育能力的妇女应在使用特立帕肽时采取有效的避孕措施。如果怀孕则应停止使用特立帕肽。
治疗期间
对大鼠的研究提示特立帕肽长期给药会使骨肉瘤发生率增加。在上市后的阶段,发生骨肿瘤和骨肉瘤的病例报道很少。其与特立帕肽使用的因果关系尚不清楚。
免责声明: 以上内容整理于FDA、DRUGS、网络,仅作信息交流之目的,文中观点不代表药队长立场,亦不代表药队长支持或反对文中观点。本文也不是治疗方案推荐。页面内容仅供医学药学专业人士阅读参考,具体用药请咨询主治医师,本站只做信息显示,不销售药品。如需获得治疗方案指导,请前往正规医院就诊。
参考资料: FDA说明书,FDA更新于2024年7月24日的说明书https://www.accessdata.fda.gov/scripts/cder/daf/index.cfm?event=BasicSearch.process&ApplNo=021318
- 药品知识
- 药品问答
- 特立帕肽是哪个厂家生产的? 随着人口老龄化的加剧,骨质疏松症已成为一种常见的骨骼疾病。为了改善骨质...[ 详情 ]推荐指数:540 2024-01-18
-
靶向新药!PI3Kα抑制剂 招募卵巢癌、输卵管癌、腹膜癌患者
[适应症]适用症复发/持续性卵巢、输卵管或原发性腹膜透明细胞癌[试验分期]Ⅱ期
-
免费治疗!CD20 CAR-T细胞疗法 招募阳性非霍奇金淋巴瘤患者
[适应症]复发/难治性CD20阳性B细胞非霍奇金淋巴瘤(B-NHL),包括:弥漫大B细胞淋巴瘤(DLBCL,包括组织学转化型)和转化型滤泡性淋巴瘤(TFL)[试验分期]Ⅰ期
-
免费新药!抗体偶联药物 招募CD20阳性B细胞非霍奇金淋巴瘤患者
[适应症]复发或难治的CD20阳性B细胞非霍奇金淋巴瘤[试验分期]Ⅰ期
-
免费新药!小分子靶向新药AST-001招募胰腺癌、肝癌、肠癌等实体瘤患者
[适应症]晚期恶性实体肿瘤(但不限于胰腺癌、肝细胞癌、非小细胞肺癌、乳腺癌、胃癌、食管癌、结肠癌、直肠癌、肾细胞癌、脑胶质瘤、前列腺癌)[试验分期]Ⅰ期