Cobenfy(KarXT)
温馨提示:图片来自公开渠道(如FDA官网、Drugs官网、原研药厂官网等),仅供参考。
- 药品百科
- 治疗效果
- 用法用量
- 副作用
- 注意事项
- 药物相互作用
适用于成人精神分裂症的治疗。
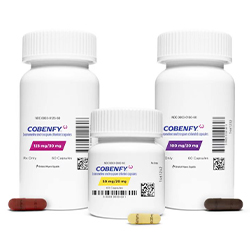
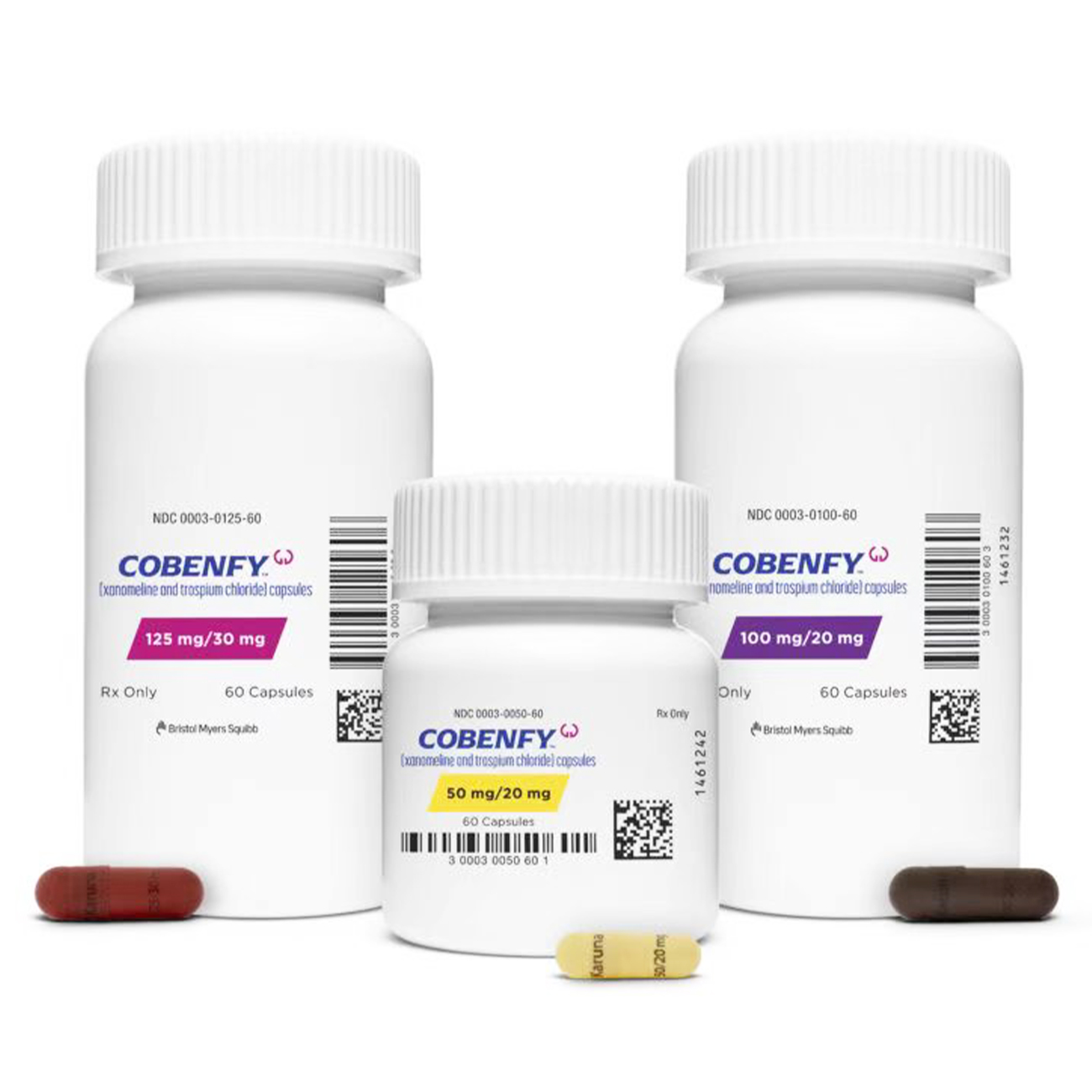
50mg/20mg:浅黄色胶囊,印有“Karuna50/20mg”;100mg/20mg:棕色胶囊,印有“Karuna100/20mg”;125mg/30mg:瑞典橙色胶囊,印有“Karuna125/30mg”。
开始治疗前及临床需要时,应评估肝酶(如ALT、AST)和胆红素水平。基线时及治疗期间根据临床需要评估心率。
起始剂量为50mg/20mg(xanomeline/trespiumchloride)口服,每日两次,持续至少2天。随后增至100mg/20mg口服,每日两次,持续至少5天。
根据患者耐受性与治疗反应,可增至125mg/30mg口服,每日两次。最大推荐剂量为125mg/30mg每日两次。应于餐前至少1小时或餐后至少2小时服用,不可打开胶囊。
老年患者建议起始剂量为50mg/20mg口服,每日两次。最大剂量100mg/20mg每日两次。建议缓慢给药,降低不良反应风险。
常见不良反应包括:恶心、消化不良、便秘、呕吐、高血压、腹痛、腹泻、心动过速、头晕、胃食管反流病。
其他临床关注的不良反应:尿潴留、肝酶升高、中枢神经系统反应如头晕/嗜睡/幻觉/意识混乱,以及视力模糊、口干、唾液分泌过多、体位性低血压等。
1.尿潴留风险
2.肝功能障碍患者使用风险
3.胆道疾病患者使用风险
4.胃肠动力下降
5.血管性水肿风险
6.窄角型青光眼
7.心率增加
8.肾功能不全患者的抗胆碱能不良反应
9.中枢神经系统效应
【孕妇】尚无人类数据。动物研究显示在母体毒性剂量下可出现胚胎-胎儿发育毒性。建议妊娠期女性使用前咨询医生。
【哺乳期女性】无人类乳汁中xanomeline或trespium的数据,但动物乳汁中检出。使用时应权衡母乳喂养的益处与婴儿潜在风险。
【具有生殖潜力的男性和女性】说明书中尚未明确。
【儿童使用】安全性与有效性未建立。
【老年人使用】推荐较低起始剂量与最大剂量,缓慢滴定,以降低尿潴留等风险。
【肾功能损害】轻度肾功能不全(eGFR60~<90mL/min)可使用常规剂量。中重度肾功能不全(eGFR<60mL/min)不推荐使用。
【肝功能损害】轻度肝损患者不推荐使用。中重度肝损患者禁用。
Cobenfy禁止用于以下患者:尿潴留、中度或重度肝功能障碍(Child-PughB或C级)、胃潴留、对Cobenfy或trespiumchloride有过敏史、未经治疗的窄角型青光眼。
1.与Cobenfy具有临床显著相互作用的药物:CYP2D6强抑制剂、经肾小管主动分泌的药物、CYP3A4敏感底物(口服)、P‑糖蛋白底物(口服)。
2.其他抗胆碱能药物
3.Cobenfy对药物吸收的影响
- 公开资料参考价
- 药品概述
- 药品信息
-
一项评价盐酸卡利拉嗪胶囊用于治疗成人急性期精神分裂症的疗效和安全性的多中心、随机、双盲、双模拟、阳性对照III期临床试验
[适应症]成人精神分裂症的治疗。成人双相I型障碍相关躁狂或混合发作的急性治疗。成人双相I型障碍(双相抑郁)相关抑郁发作的治疗。[试验分期]Ⅲ期