厄达替尼(Balversa)的说明书
厄达替尼是一种口服的小分子酪氨酸激酶抑制剂,专门用于治疗具有易感FGFR基因突变的局部晚期或转移性尿路上皮癌(mUC)的成年患者。目前尚未在国内上市,本文就厄达替尼的适应症、用法用量、副作用、禁忌、临床疗效等进行了详细说明。
(一)适应症
厄达替尼适用于在至少一种先前的全身治疗中或之后出现进展、具有易感FGFR3基因改变的局部晚期或转移性尿路上皮癌(mUC)的成年患者。厄达替尼不推荐用于符合条件但未接受PD-1或PD-L1抑制剂治疗的患者。
厄达替尼
(二)用法用量
1.患者选择
根据FDA批准的伴随诊断检测到的肿瘤标本中存在易感FGFR3遗传改变,选择厄达替尼治疗局部晚期或转移性尿路上皮癌的患者。
2.用药管理
用药时需整片吞下,可伴随或不伴随食物服用。如果在服用厄达替尼后任何时间出现呕吐,则应在第二天服用下一次剂量。治疗应持续到疾病进展或出现不可接受的毒性。
如果漏服一剂厄达替尼,可在同一天尽快补服,第二天恢复厄达替尼的常规每日剂量计划,不应该额外服用药片来弥补错过的剂量。
3.推荐用量
厄达替尼的推荐起始剂量为8mg(2片4mg药片),每日一次。根据耐受性(包括高磷血症),剂量可增加至9mg(3片3mg药片),每日一次,持续14至21天。
基于血清磷酸盐水平的剂量增加:开始治疗后14至21天评估血清磷酸盐水平。如果血清磷酸盐水平<9.0mg/dL且无眼部疾病或2级以上不良反应,厄达替尼剂量增加至9mg,每日一次。每月监测高磷血症的磷酸盐水平。
4.不良反应的剂量调整
不良反应的推荐剂量修改列于表1。
表1:厄达替尼剂量减少表
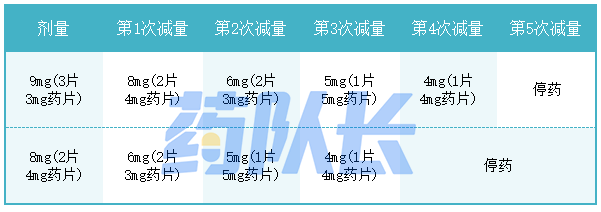
表2总结了在处理特定不良反应时中断、减少或停药厄达替尼的建议。
表2:不良反应的剂量调整


*使用美国国家癌症研究所不良事件通用术语标准
(三)适用人群
成人。妊娠期、哺乳期女性,儿童以及老年患者在医生指导下用药。
(四)禁忌症
尚不明确。
(五)副作用
最常见(>20%)的不良反应,包括实验室异常,有磷酸盐升高、指甲病变、口炎、腹泻、肌酐升高、碱性磷酸酶升高、丙氨酸转氨酶升高、血红蛋白降低、钠降低、天冬氨酸转氨酶升高、疲劳、口干、皮肤干燥、磷酸盐降低、食欲减退、嗅觉障碍、便秘、钙升高、干眼、掌跖红肿综合征、钾升高、脱发和中枢性浆液性视网膜病变。
(六)注意事项
1.眼部疾病
厄达替尼可引起眼部疾病,包括中枢性浆液性视网膜病变/视网膜色素上皮脱离(CSR/RPED),导致视野缺损。所有患者应接受干眼症预防,并根据需要使用眼部镇痛药。
在治疗的前4个月和之后每3个月进行一次眼科检查,并随时检查视力症状。眼科检查应包括视力评估、裂隙灯检查、眼底镜检查和光学相干断层扫描。根据严重程度和/或眼科检查结果,暂停或永久停用厄达替尼。
2.高磷血症与软组织矿化
在整个治疗过程中监测高磷血症。限制饮食中磷酸盐的摄入(每天600-800mg),避免同时使用可能增加血清磷酸盐水平的药物。
如果血清磷酸盐高于7.0mg/dL,考虑添加口服磷酸盐结合剂,直到血清磷酸盐水平恢复到<7.0mg/dL。根据高磷血症的持续时间和严重程度,暂停、减少剂量或永久停用厄达替尼。
3.胚胎-胎儿毒性
告知孕妇对胎儿的潜在风险。建议有生育潜力的女性和男性患者在厄达替尼治疗期间和最后一次服药后一个月内使用有效的避孕措施,以减少对胎儿的伤害。
(七)治疗效果
1.试验设计
对一线和二线全身治疗失败的mUC患者进行原发性或转移性肿瘤组织中FGFR2/3改变的筛查。选择FGFR2/3改变的患者按标准给药方案接受厄达替尼治疗,并前瞻性随访以评估疗效和安全性结局。来自巴西10个中心的47名mUC患者接受了FGFR2/3改变检测。
2.试验结果
在12例患者(25.5%)中发现FGFR2/3的改变,并且所有患者都符合EAP条件。4例患者(33%)部分缓解,2例患者(17%)病情稳定。在5例患者(42%)中观察到进行性疾病,反应最佳。中位随访时间为16.2个月,中位治疗失败时间(TTF)为2.8个月。当仅考虑具有客观缓解的患者时,中位TTF为5.3个月。
3.试验结论
该试验显示厄达替尼在携带FGFR2/3改变的肿瘤患者中具有显着活性,证明了厄达替尼在缺乏治疗选择的疾病环境中的疗效和安全性。
(八)药物相互作用
1.其他药物对厄达替尼的影响
表3总结了影响厄达替尼暴露或血清磷酸盐水平的药物相互作用及其临床处理。
表3:影响厄达替尼的药物相互作用


2.厄达替尼对其他药物的影响
表4总结了厄达替尼对其他药物的影响及其临床管理。
表4:影响其他药物的厄达替尼药物相互作用

(九)储存条件
储存在20°C至25°C;允许偏差在15°C至30°C之间。
【温馨提示】:部分商品说明书更换频繁,请以商品实物为准。

厄达替尼适用于在至少一种先前的全身治疗中或之后出现进展、具有易感FGFR3基因改变的局部晚期或转移性尿路上皮癌(mUC)的成年患者。厄达替尼不推荐用于符合条件但未接受PD-1或PD-L1抑制剂治疗的患者。






