1.低级别胶质瘤(LGG)
LGG是最常见的小儿脑癌,其发病率随年龄增长而增加。BRAFV600突变存在于15-20%的儿童 LGG中,并且与不良的生存结局和对化疗反应较差相关。因此,对 BRAF突变进行研究并确定其与癌症生长的关系对于临床诊断和治疗具有重要意义。此外, BRAF突变已被确定为多种实体瘤中癌症生长的驱动因素,并且通常治疗选择有限。因此,对 BRAF突变进行深入研究将有助于提高癌症治疗的疗效。
2.达拉非尼+曲美替尼,联合靶向疗法
达拉非尼商品图
3月16日,诺华(Novartis)宣布美国 FDA批准了达拉非尼与曲美替尼联合用于治疗1岁及以上需要全身治疗的 BRAFV600E突变的低级别胶质瘤(LGG)儿童患者。此次批准是首次开发出一种 BRAF/MEK抑制剂,用于小至一岁的患者,这些批准使达拉非尼与曲美替尼成为首个获批用于治疗 BRAFV600E LGG儿童患者的联合靶向疗法。FDA还批准了达拉非尼和曲美替尼看的液体制剂,标志着首次获得了关于其在更广泛年龄人群中的有效性和安全性数据。此外,这些批准也为患者提供了一种新的治疗选择,从而改善了他们的生存。
曲美替尼商品图
此次FDA批准是达拉非尼和曲美替尼获准的第六个适应症。达拉非尼和曲美替尼此前获批用于多种BRAF V600实体瘤,包括黑色素瘤、甲状腺癌和肺癌。达拉非尼和曲美替尼组合可能通过阻断与BRAF和MEK激酶相关的信号来减缓肿瘤生长,而这些信号与各种类型癌症的生长有关。
3.达拉非尼与曲美替尼联合靶向疗法疗效如何
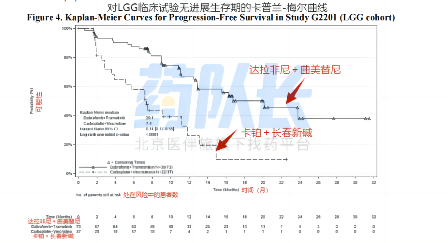
此次FDA批准达拉非尼与曲美替尼的新适应症,是基于2/3期临床试验TADPOLE的结果。该试验的结果显示,随机接受达拉非尼与曲美替尼治疗的患者的总缓解率(ORR)为47%,而随机接受传统化疗的患者仅为11%。在18.9个月的中位随访期内,接受达拉非尼与曲美替尼治疗的患者中位无进展生存期(PFS)为20.1个月,而传统化疗组患者的中位无进展生存期(PFS)为7.4个月。
美国国家儿童医学中心神经科学与行为医学高级副总裁Roger Packer博士说:“在低级别胶质瘤患者中检测基因突变比以往任何时候都更重要。此次FDA的批准可能为携带BRAF V600E低级别胶质瘤的儿童患者提供新的希望,这有可能改变医疗服务提供者治疗这些儿科患者的方式,与化疗相比提供了显著的进步。”

美国国家儿童医学中心神经科学与行为医学高级副总裁Roger Packer博士(图片取自谷歌)
免责声明: 以上内容整理于FDA说明书、DRUGS及网络,仅作信息交流之目的,文中观点不代表药队长立场,亦不代表药队长支持或反对文中观点。本文也不是治疗方案推荐。页面内容仅供医学药学专业人士阅读参考,具体用药请咨询主治医师,本站只做信息展示,不销售药品。如需获得治疗方案指导,请前往正规医院就诊。
参考资料: https://www.accessdata.fda.gov/scripts/cder/daf/index.cfm