
 请您输入药品名
请您输入药品名

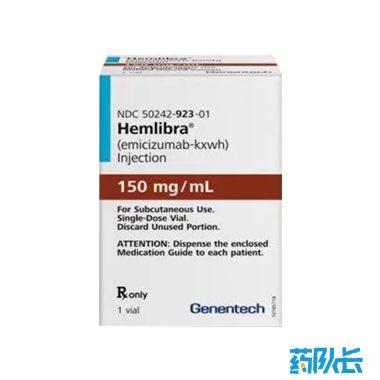
艾美赛珠单抗注射液
![$drugs['manufacturersinfo']['name'].jpg](https://m.1blv.cn/upload/default/20220420/cd3ddaba94402b3ec87a16bff64b062.jpg) 美国Genentech
美国Genentech 治疗A型血友病的双特异性抗体,零治疗出血率高
-
别名:艾米珠单抗、舒友立乐、Emicizumab、Hemlibra、Injektionslösung、Hemlibra

-
剂型:注射剂
-
规格:150mg
-
有效期:24个月
-
上市时间:2017年11月
由于各临床试验间差异很大,因此一种药物在临床试验中观察到的不良反应发生率,不能与另一种药物在临床试验中的发生率直接比较,也可能无法反映临床实践中观察到的发生率。
以下不良反应(ADR)根据一项随机试验(HAVEN1)、一项单臂试验(HAVEN2)和一项剂量探索试验的汇总数据总结。
共189例男性A型血友病患者接受至少一剂艾美赛珠单抗常规预防治疗,其中94例(50%)成年人患者(≥18岁),38例(20%)青少年患者(≥12~<18岁),55例(29%)儿童患者(≥2~<12岁),2例(1%)婴儿(1个月~<2岁)。
189例安全性人群中7例(4%)患者来自剂量探索试验的FVIII抑制物阴性患者。
所有研究的中位暴露时间为38周(范围:0.8~177.2周)。
在接受至少一剂艾美赛珠单抗治疗的患者中,观察到的发生率≥10%的最常见ADR是注射部位反应、头痛和关节痛。
临床试验中,共4例(2.1%)接受艾美赛珠单抗预防治疗的患者因ADR(血栓性微血管病,皮肤坏死及浅表性血栓性静脉炎,注射部位反应)退出治疗。
下文表1按MedDRA系统器官分类列出临床试验中接受艾美赛珠单抗治疗患者出现的药物不良反应。
各ADR的发生频率采用以下分类方式:十分常见(≥1/10),常见(≥1/100至<1/10),以及偶见(≥1/1,000至<1/100)。
详见药品说明书
 4001551018
4001551018
 印度natco
印度natco 
 瑞士诺华
瑞士诺华 









