如何监管上市后药品?
药品上市后,并不意味着一脚迈进“安全地带”,不论是中国、美国,还是欧洲,药品上市后监管始终将患者的用药安全放在首位。美国采取“哨点计划”,欧洲采用上市后研究,而我国早在2019年《药品管理法》就已提出建立药物警戒体系,对药品不良反应及其他与用药有关的有害反应进行监测、识别、评估和控制,严格了药物研发至上市后的风险管控,在药品上市后,监督其药品质量、疗效和安全性等,能够进一步保证患者的用药安全。
中国药物警戒体系
中国药物警戒体系包括:
1.国家药品不良反应监测系统
2.药品上市许可持有人药品不良反应直接报告系统
3.中国医院药物警戒系统
国家药品不良反应监测系统
2012年,国家药品不良反应监测系统正式成立,医疗机构、药品生产企业和经营企业或个人可将临床治疗相关的不良反应上报至该系统,最终通过不良反应监测中心将整合的不良反应数据汇总给国家药监局。
小儿酚氨咖敏颗粒就是通过这一系统,观察到儿童发热患者服用后,普遍出现肝肾损害,因此被国家注销和召回,值得注意的是,这种监督方式,是被动且强制。
药品不良反应监测系统的上报流程
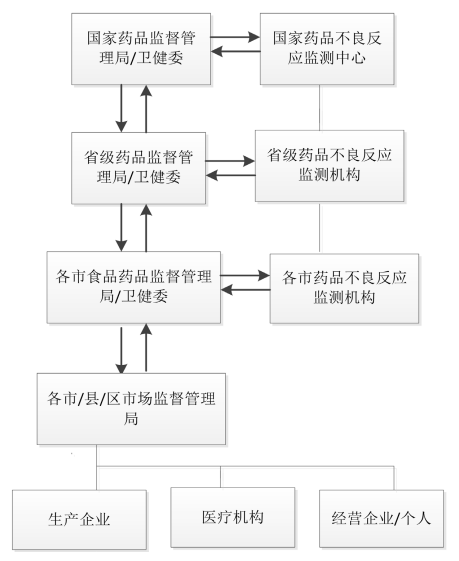
药品不良反应监测系统的流程图
国家药监局—小儿酚氨咖敏颗粒注销!停产!召回!
2021年11月,国家药监局发布注销多款已上市药品注册证书的公告,小儿酚氨咖敏颗粒位列其中,将“全面停产、禁止销售、召回销毁”,注销药品注册证书,这意味着该药品将退出国内市场,这是国家药品不良反应监测系统发挥其职能的典型示范,在使用中监测到小儿酚氨咖敏颗粒会对儿童的肝肾功能造成不良反应。这不是药监局第一次管控解热镇痛类药品,曾经的“退热神药”—安乃近不仅限购,部分剂型甚至惨淡退场。

药监局注销小儿酚氨咖敏颗粒的公告
药品上市许可持有人药品不良反应直接报告系统
药品上市许可持有人需建立药品安全委员会,设立专门的药物警戒部门,由以下人员构成:
(1)持有人的法定代表人或主要负责人
(2)药物警戒负责人
(3)药物警戒部门及相关部门负责人等
药物警戒部门对上市后药品的质量、疗效、安全性等主动监督,发现问题及时上报,提出主动召回或注销药品的申请,是药品上市许可持有人应承担的义务。
中国医院药物警戒系统
中国医院药物警戒系统(CHPS)简单来说,就是将多家医院的患者病例共同收录到同一系统中,正在使用同款药物的患者,出现相似的症状和体征,考虑是否是因药物治疗导致的。
临床医生又被大家称为“吹哨人”,临床医生通过CHPS,能够更快的抓取临床信息,为上报药品问题提供依据,提高了医院主动监测和预警的能力。
目前,CHPS还处于试点阶段,2020年,北海市人民医院加入国家级药品不良反应监测哨点联盟,这意味着药品上市后不良反应主动监测新模式的开启[5]。
美国上市后药品监管—哨点计划
中国的CHPS借鉴了美国的“哨点计划”,早在2008年5月美国药监局(FDA)就已开启该计划的探索,但中国的CHPS数据仅来源于医院临床医生接手的病例,来源相对单一,美国的医疗数据则更加丰富[4]:
(1)电子病历数据库
(2)医疗保险数据库
(3)药品监管数据库
(4)人口统计学数据库等
中美两国创建药品主动安全监测系统都是为了更安全、更合理的用药,美国现也处于试点阶段,现已启动“迷你哨点计划”,该计划的运行的基础是数据合作伙伴联盟(提供数据的平台或机构),受FDA监管。
欧洲药监局—药品上市后有效性研究
当药品发生以下变动时,欧洲药监局会要求药品上市许可持有人,进行药品上市后有效性研究(PAES),即为通过设计新的研究,对上市后药品得疗效、安全性等方面进行再评估:
(1)临床试验中替代终点改变
(2)增加联合用药选择
(3)不同人群用药
(4)长期用药
(5)实际临床应用比上市前的临床试验中的使用更加复杂
(6)对疾病或药物认识更新
(7)疗效标准发生改变
PAES能够探索药品在真实临床环境应用中所产生的实际疗效,是药品全生命周期监管的重要环节[6]。
药品上市后有效性研究方案审批流程
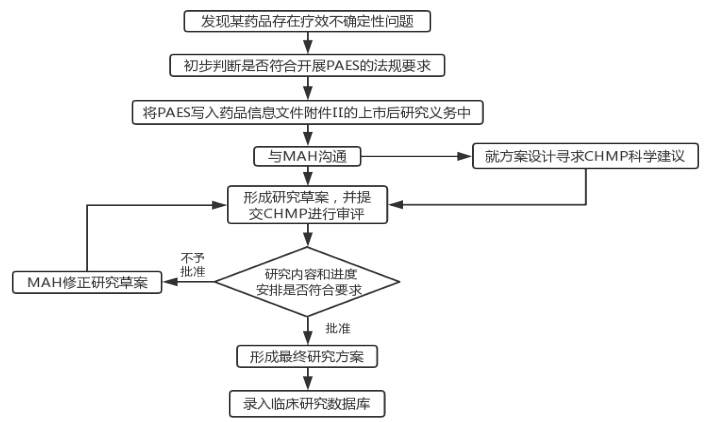
PAES方案审批流程图
药品上市后有效性研究结果评估流程
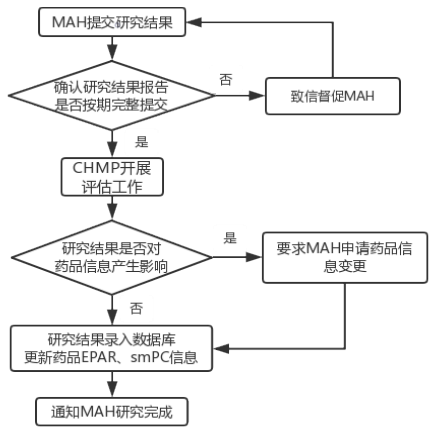
PAES结果审批图
抗肿瘤药与其他药上市后监管的区别
2018年,纳武单抗成为我国首个获批的抗PD-1类抗肿瘤药,此后三年又有十余个PD-1/PD-L1药品在国内上市,如特瑞普利单抗、信迪利单抗、卡瑞利珠单抗、阿替利珠单抗等,甚至有多款药物已进入我国国家医保目录[7]。
纳武单抗 美国施贵宝 40mg/4ml
肿瘤药物特性
尽管大多数抗肿瘤药的不良反应的发生率,尤其是严重不良反应发生风险明显高于其他药物,但抗肿瘤药物却可以拯救或延长患者的生命(获益>风险),临床上并没有因为它的不良反应而停止应用。
与其他药上市后再评价和监督的区别
上市后的抗肿瘤药再评价和监督,相较于其他药略宽松,并且有单独的不良反应评价标准,比如国际肿瘤化疗药物不良反应评价系统——通用不良反应术语标准4.0版(CTCAE v4.0),值得注意的是,肿瘤的不良标准仍在不断更新完善中。
上市后药品监管对患者的启示
虽然各国都有严格的上市后监管方法,不论患者购买进口药还是国产药,都需要选择合法的购买渠道,购买正品药物,同时,还要患者了解药物治疗可能会发生的不良反应及相关的处理措施,若发生不可自行处理的不良反应需立即上报给医生或直接去医院,最重要的是,一定要积极配合医生治疗并且合理用药,获取最佳疗效。


1.不可切除或转移性黑色素瘤
作为单药或与伊匹木单抗联合使用,适用于治疗不可切除或转移性黑色素瘤的成年患者
2.黑色素瘤的辅助治疗
适用于已完全切除的伴有淋巴结或转移性黑色素瘤的成年患者的辅助治疗
3.可切除非小细胞肺癌的新辅助治疗
联合铂-双联体化疗,被认为是可切除(肿瘤≥4 cm或淋巴结阳性)成年非小细胞肺癌(NSCLC)患者的新辅助治疗
4.转移性非小细胞肺癌
(1)联合伊匹木单抗用于经fda批准的检测确定肿瘤表达PD-L1(≥1%)且无EGFR或ALK基因组肿瘤异常的转移性非小细胞肺癌成人患者的一线治疗
(2)联合伊匹木单抗和2个周期铂-双联化疗,适用于无EGFR或ALK基因组肿瘤畸变的转移性或复发性非小细胞肺癌的一线治疗
(3)适用于在铂基化疗中或化疗后进展的转移性非小细胞肺癌成年患者治疗
5.恶性胸腔间皮瘤
联合伊匹木单抗被用于成人恶性胸膜间皮瘤患者的一线治疗
6.晚期肾细胞癌
(1)与伊匹木单抗联合用于中低风险晚期肾细胞癌成人患者的一线治疗
(2)联合卡博替尼用于晚期肾细胞癌成人患者的一线治疗
(3)作为单一药物用于治疗既往接受过抗血管生成治疗的晚期肾细胞癌成人患者
7.经典霍奇金淋巴瘤
适用于复发或进展的经典霍奇金淋巴瘤成年患者的治疗
8.头颈部鳞状细胞癌
适用于复发性或转移性头颈部鳞状细胞癌的成人患者,在铂类药物治疗或治疗后疾病进展
9.移行细胞癌
(1)适用于成人尿路上皮癌根治性切除术后复发风险高的患者的辅助治疗
(2)适用于治疗局部晚期或转移性尿路上皮癌的成年患者,这些患者在含铂化疗期间或之后疾病进展或者在新辅助或含铂化疗辅助治疗后12个月内疾病进展
10.微卫星不稳定性高或错配修复缺陷转移性结直肠癌
作为单药或与伊匹木单抗合用,适用于治疗12岁及以上患有高微卫星不稳定性或错配修复缺陷转移性结直肠癌的成人和儿童患者,这些患者在氟嘧啶、奥沙利铂和伊立替康治疗后进展
11.肝细胞癌
与伊匹木单抗联合用于治疗先前曾使用索拉非尼治疗的成年肝细胞癌患者
12.食道癌
适用于已接受新辅助放化疗的完全切除的食管或胃食管交界处癌伴残留病理疾病的成年患者的辅助治疗
(1)联合含氟嘧啶和铂的化疗,用于不能切除的晚期或转移性食管鳞状细胞癌成人患者的一线治疗
(2)联合伊匹木单抗用于不可切除的晚期或转移性食管鳞状细胞癌成人患者的一线治疗
(3)适用于既往氟嘧啶和铂基化疗后不可切除的晚期、复发或转移性食管鳞状细胞癌(ESCC)成人患者的治疗
13.胃癌、胃食管交界癌和食管腺癌
联合含氟嘧啶和铂的化疗,适用于晚期或转移性胃癌、胃食管交界处癌和食管腺癌的成人患者的治疗